Παναγιώτα Καραμιχάλη κτηνίατρος, MSc, Κυριακή Φτεργιώτη κτηνίατρος, Γεώργιος Καζάκος κτηνίατρος, PhD
Κλινική Ζώων Συντροφιάς, Τμήμα Κτηνιατρικής, Α.Π.Θ., Θεσσαλονίκη
MeSH keywords:
anesthesia, deep sedation, rabbits, rodents
Περίληψη
Στο άρθρο παρουσιάζονται οι φυσιολογικές ιδιαιτερότητες του εκάστοτε είδους και οι περιεγχειρητικοί κίνδυνοι που μπορεί να προκύψουν. Επίσης, περιγράφονται η προαναισθητική διαχείριση, πιθανά αναισθητικά πρωτόκολλα, η επιλογή του κατάλληλου αναισθητικού σχήματος για την εγκατάσταση και διατήρηση της αναισθησίας και τέλος οι αρχές μετεγχειρητικής φροντίδας. Αναφορά γίνεται μόνο σε δραστικές ουσίες που βρίσκονται στην αγορά και μπορεί να αποκτήσει ο Έλληνας κτηνίατρος. Σκοπός είναι η ελαχιστοποίηση των επιπλοκών που μπορεί να αποβούν μοιραίες κατά τη διάρκεια της αναισθησίας σε ένα ιατρείο ζώων συντροφιάς.
Εισαγωγή
Στα μικρά κατοικίδια θηλαστικά που απαντώνται συνηθέστερα στην Ελλάδα περιλαμβάνονται ο κόνικλος (οικογένεια Leporidae - Λαγόμορφα) και είδη της τάξης Rodentia – Τρωκτικά (μυς, επίμυς, κρικητός/χάμστερ, γερβίλος, ινδικό χοιρίδιο, τσιντσιλά). Ο κόνικλος και τα τρωκτικά εμφανίζουν συχνά σοβαρές επιπλοκές και πεθαίνουν κατά τη διάρκεια της αναισθησίας, γεγονός που αναγκάζει ιδιοκτήτες αλλά και κτηνιάτρους να τις αποφεύγουν. Πράγματι, το ποσοστό θνησιμότητας αν και δεν είναι ιδιαίτερα υψηλό, είναι υψηλότερο σε σχέση με το σκύλο και τη γάτα (Brodbelt 2009).
Ανατομικές και φυσιολογικές ιδιαιτερότητες και επιπτώσεις τους στην αναισθησία
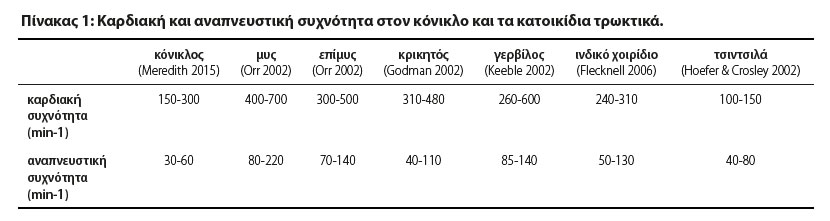
Στον Πίνακα 1 παρουσιάζονται μερικές φυσιολογικές κλινικές παράμετροι στον κόνικλο και τα κατοικίδια τρωκτικά. Σημαντική ιδιαιτερότητα που θα πρέπει να λαμβάνεται υπόψιν κατά την περιεγχειρητική περίοδο είναι η σχετικά μεγάλη επιφάνεια του σώματος συγκριτικά με το σωματικό τους βάρος, η οποία προδιαθέτει σε εκδήλωση υποθερμίας κατά τη διάρκεια της αναισθησίας. Επίσης, ο υψηλός μεταβολικός ρυθμός τους σε συνδυασμό με τα μικρά αποθέματα γλυκογόνου, μπορούν να οδηγήσουν σε υπογλυκαιμία (Flecknell 2016). Επιπλέον, τα παρεντερικά χορηγούμενα φάρμακα έχουν ταχύτερη έναρξη δράσης αλλά μικρότερη διάρκεια. Σε περίπτωση άπνοιας, η αντίδραση του κτηνιάτρου πρέπει να είναι ταχύτατη. Ζωτικοί ιστοί (όπως το κεντρικό νευρικό σύστημα) πολύ γρήγορα καθίστανται υποξικοί, λόγω του υψηλού μεταβολικού ρυθμού τους και της μεγάλης κατανάλωσης οξυγόνου (Quesenberry & Carpenter 2012).
Ο καθετηριασμός περιφερικής φλέβας και η διασωλήνωση της τραχείας παρουσιάζουν δυσκολίες, λόγω της ιδιαίτερης ανατομικής κατασκευής και του μεγέθους αυτών των ζώων (δυσκολία θέασης λάρυγγα, λαρυγγόσπασμος), γεγονός που απαιτεί ειδικό και κατάλληλου μεγέθους εξοπλισμό (Harkness et al. 2010).
Οι απαιτούμενες αναισθητικές δόσεις συχνά είναι μικρότερες από αυτές που είναι δημοσιευμένες σε μελέτες, κατά τις οποίες έχουν χρησιμοποιηθεί υγιή και εξοικειωμένα σε χειρισμούς ζώα (Harkness et al. 2010). Η συνύπαρξη άλλων παθολογικών καταστάσεων, οι περισσότερες από τις οποίες είναι ασυμπτωματικές (π.χ. παστερέλλωση, σήψη, νεοπλασία του πνεύμονα, αδενοκαρκίνωμα της μήτρας), μπορεί να επηρεάσουν τη λειτουργία του αναπνευστικού συστήματος κατά την αναισθησία.
Στον κόνικλο, η ξαφνική αντίδρασή τους σε κακούς χειρισμούς, μπορεί να προκαλέσει κατάγματα στη σπονδυλική στήλη, ενώ το έντονο στρες μπορεί να προκαλέσει αρρυθμίες λόγω έκκρισης κατεχολαμινών (Cantwell 2001). Για την ελαχιστοποίηση του στρες στον προαναισθητικό θάλαμο πρέπει οι κλωβοί να είναι μακριά από οπτικά και ακουστικά ερεθίσματα. Επιπλέον, να γίνεται συστέγαση όμοιων ειδών και συγκράτηση των ζώων με ελάχιστους χειρισμούς, μόνο από εξοικειωμένο προσωπικό.
Η μεγάλη περίοδος προαναισθητικής νηστείας, ο αυξημένος χειρουργικός χρόνος, το έντονο στρες λόγω πόνου και η αλλαγή περιβάλλοντος, μπορεί να προδιαθέσουν σε μετεγχειρητικό ειλεό. Ο τυμπανισμός λόγω στάσης γαστρεντερικού περιεχομένου μειώνει τη δύναμη σύσπασης του διαφράγματος και αυξάνει την ενδοκοιλιακή πίεση, με πιθανή επιπτώσεις στο αναπνευστικό και καρδιαγγειακό σύστημα (Flecknell 2016).
Η εκτίμηση του βάρους πρέπει να γίνεται με μεγάλη ακρίβεια, ειδικά στα πολύ μικρά ζωικά είδη (Harkness et al. 2010). Στα τρωκτικά, κυρίως τους μυς και τους επίμυς, για τη χορήγηση υγρών προτιμάται η υποδόρια και η ενδοπεριτοναϊκή οδός, αλλά όχι για υγρά που περιέχουν γλυκόζη.
Προαναισθητική νηστεία
Στους κονίκλους και τα κατοικίδια τρωκτικά, εξαιτίας της ταχείας γαστρικής κένωσης και της πιθανότητας πρόκλησης στάσης του γαστρεντερικού περιεχομένου, δεν εφαρμόζεται προαναισθητική νηστεία. Επομένως τα ζώα έχουν ελεύθερη πρόσβαση σε φαγητό και νερό μέχρι τη στιγμή της χορήγησης προαναισθητικής αγωγής (Flecknell 2006). Επιπλέον, η νηστεία εξαντλεί τα αποθέματα γλυκογόνου, προκαλώντας υπογλυκαιμία, η οποία μπορεί να συμβάλλει σημαντικά στην πρόκληση μετεγχειρητικού ειλεού.
Τα τρωκτικά δεν κάνουν έμετο, επομένως η προαναισθητική νηστεία δεν είναι απαραίτητη. Ωστόσο, τα ινδικά χοιρίδια συχνά διατηρούν τροφή στο οπίσθιο τμήμα της στοματικής κοιλότητας, γιαυτό συνιστάται νηστεία 2-3 ωρών προεγχειρητικά και απομάκρυνση των υπολειμμάτων τροφής με βαμβακοφόρο στυλεό, μετά την εγκατάσταση της αναισθησίας (Horn et al. 2013).
Στους μεγαλόσωμους και παχύσαρκους κονίκλους προαναισθητική νηστεία μίας ώρας μπορεί να μειώσει τον όγκο του στομάχου και του τυφλού, που θεωρητικά συμπιέζουν την περιορισμένη θωρακική κοιλότητα. Στην πράξη ωστόσο, δεν μεταβάλλει τον όγκο του γαστρεντερικού σωλήνα επαρκώς, ώστε να θεωρείται κλινικά σημαντική (Quesenberry & Carpenter 2012).
Προαναισθητική αγωγή και ηρέμηση
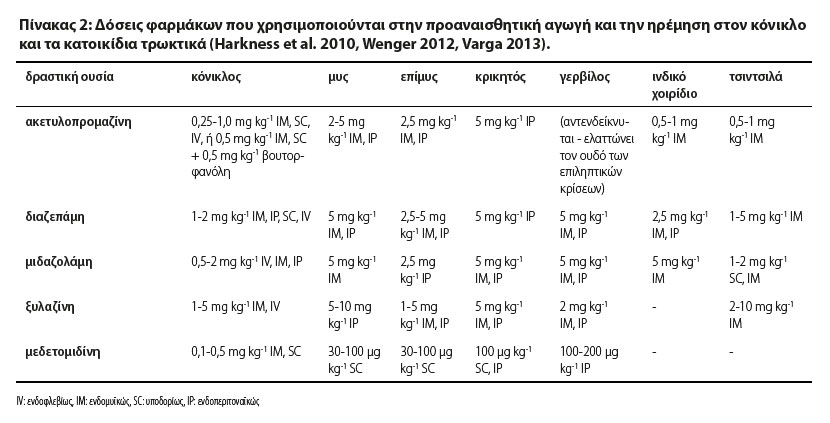
Στον Πίνακα 2 παρουσιάζονται δόσεις φαρμάκων που χρησιμοποιούνται στην προαναισθητική αγωγή και την ηρέμηση των κονίκλων και των κατοικίδιων τρωκτικών.
Ένας σημαντικός παράγοντας που λαμβάνεται υπόψιν κατά την επιλογή των φαρμάκων της προαναισθητικής αγωγής είναι η ταχεία ανάνηψη. Μεγάλη διάρκεια ανάνηψης μπορεί να προκαλέσει γαστρεντερικά προβλήματα, ηπατική λιποείδωση και υπογλυκαιμία (Bonath et al. 1982). Για αυτό το λόγο προτιμάται να χρησιμοποιούνται φάρμακα με ευρύ «παράθυρο ασφάλειας» ή με ανταγωνιστές που επιτρέπουν αναστροφή της δράσης τους (π.χ. μεδετομιδίνη-ατιπαμεζόλη). Επιπλέον, καλύτερο αποτέλεσμα επιτυγχάνεται με συνδυασμούς φαρμάκων. Ο συνδυασμός φαρμάκων λειτουργεί αθροιστικά στην επίτευξη της ηρέμησης και ελαχιστοποιεί της παρενέργειές τους (Richardson & Flecknell 2005).
Αντιχολινεργικά (ατροπίνη, γλυκοπυρρολάτη)
Τα αντιχολινεργικά φάρμακα μειώνουν τη δράση του παρασυμπαθητικού συστήματος προκαλώντας ταχυκαρδία, μείωση των βρογχικών εκκρίσεων και μυδρίαση. Ενδείκνυνται σε επεμβάσεις που προκαλείται διέγερση του πνευμονογαστρικού νεύρου εξαιτίας χειρουργικών χειρισμών (χειρισμοί των σπλάχνων, ενδοτραχειακή διασωλήνωση), καθώς και σε συνδυασμό με οπιοειδή, όπως η φαιντανύλη, που μπορεί να προκαλέσουν βραδυκαρδία (Flecknell 2016).
Η χορήγηση αντιχολινεργικών συνιστάται στα ινδικά χοιρίδια, καθώς οι αναπνευστικές εκκρίσεις είναι πυκνόρευστες και άφθονες, ανεξάρτητα αν το ζώο διασωληνώνεται, φέρει μάσκα ή είναι προσωρινά ακινητοποιημένο (Cantwell 2001). Η ατροπίνη είναι σχετικά αναποτελεσματική στον κόνικλο, λόγω παρουσίας ατροπινεστερασών στο αίμα (AtrE), με αποτέλεσμα να απαιτούνται υψηλές δόσεις του φαρμάκου (Harrison et al. 2006). Σε τέτοιες περιπτώσεις προτιμάται η γλυκοπυρρολάτη, η οποία όμως δεν κυκλο- φορεί στην Ελλάδα. Αξιοσημείωτο είναι πως η χορήγηση ατροπίνης μαζί με α-2 αδρενεργικούς αγωνιστές δεν αντενδείκνυται στα ζώα αυτά, σε αντίθεση με τα σαρκοφάγα ζώα συντροφιάς (Alibhai et al. 1996).
Βενζοδιαζεπίνες (διαζεπάμη, μιδαζολάμη)
Οι βενζοδιαζεπίνες είναι ήπια ηρεμιστικά και αγχολυτικά φάρμακα με μυοχαλαρωτική δράση. Δεν παρουσιάζουν αναλγητικές ιδιότητες. Έχουν μικρή κατασταλτική δράση στο κυκλοφορικό και αναπνευστικό σύστημα και μικρή διάρκεια δράσης (30-60 λεπτά).
Η μιδαζολάμη, χορηγούμενη ενδομυϊκά ή ενδοφλέβια στον κόνικλο και τα κατοικίδια τρωκτικά, μπορεί να προκαλέσει ικανοποιητική ηρέμηση για διαγνωστικές εξετάσεις, π.χ. ακτινογράφηση, υπερηχοτομογραφία (Johnson-Delaney 2010). Όταν συνδυάζεται σε χαμηλότερες δόσεις με οπιοειδή (π.χ. βουτορφανόλη) ή α-2 αγωνιστές (π.χ. δεξμεδετομιδίνη) αυξάνει την προκαλούμενη ηρέμηση (Cantwell 2001, Boehm et al. 2010, Schernthaner et al. 2011). Πρόσφατα έχει περιγραφεί και ενδορρινική χορήγησή της, σε συνδυασμό με α-2 αγωνιστές και οπιοειδή για πρόκληση βαθιάς ηρέμησης στον κόνικλο (Santangelo et al. 2016).
Η διαζεπάμη μπορεί να χορηγηθεί δια του στόματος ή ενδοφλέβια. Στην ενδοφλέβια χορήγηση, μπορεί να προκληθεί ερεθισμός των αγγείων (Flecknell 2009, Papich 2016). Η απορρόφηση ύστερα από ενδομυϊκή ή υποδόρια έγχυση είναι ερεθιστική λόγω της υψηλής ωσμωτικότητας του διαλύματος (Quesenberry & Carpenter 2012).
Η φλουμαζενίλη αντιστρέφει τη δράση των βενζοδιαζεπινών, αλλά λόγω του μικρότερου χρόνου ημίσειας ζωής της, μπορεί μετά το μεταβολισμό της να επανέλθει η ηρεμιστική δράση των βενζοδιαζεπινών (Barr 2007).
Φαινοθειαζίνες (ακετυλοπρομαζίνη)
Η ακετυλοπρομαζίνη έχει χρησιμοποιηθεί στον κόνικλο και τα κατοικίδια τρωκτικά εξασφαλίζοντας ελαφρά ηρέμηση, χωρίς όμως να έχει αναλγητική δράση. Χορηγείται από όλες τις οδούς (υποδόρια, ενδομυϊκά, ενδοφλέβια, από το στόμα) και μειώνει τις δόσεις των αναισθητικών φαρμάκων. Οι φαινοθειαζίνες γενικά προκαλούν υποθερμία και ήπια υπόταση λόγω περιφερικής αγγειοδιαστολής, επομένως αντενδείκνυνται σε ζώα υπογκαιμικά, αναιμικά ή σε σοκ. Η ακετυλοπρομαζίνη ειδικά, ελαττώνει την παραγωγή δακρύων στον κόνικλο, προκαλώντας σοβαρές παθήσεις στον επιπεφυκότα και στον κερατοειδή (Ghaffari et al. 2009). Η χρήση της αντενδείκνυται στο γερβίλο διότι μειώνει τον ουδό της επιληπτογένεσης (Quesenberry & Carpenter 2012).
α-2 Αδρενεργικοί αγωνιστές (ξυλαζίνη, μεδετομιδίνη, δεξμεδετομιδίνη)
Οι α-2 αδρενεργικοί αγωνιστές προκαλούν βαθιά ηρέμηση ενώ παράλληλα έχουν αναλγητικές και μυοχαλαρωτικές ιδιότητες. Σε συνδυασμό με κεταμίνη παρέχουν χειρουργική αναισθησία. Σε κάθε περίπτωση συστήνεται και η χορήγηση οξυγόνου (Quesenberry & Carpenter 2012). Χαρακτηριστικά, μειώνουν την κινητικότητα του εντέρου, προκαλώντας παράταση του χρόνου γαστρεντερικής διάβασης. Οι α-2 αγωνιστές επίσης επηρεάζουν τη θερμορύθμιση στον κόνικλο, τον επίμυ και το ινδικό χοιρίδιο (Szreder 1993). Ένα από τα σημαντικότερα πλεονεκτήματα της μεδετομιδίνης αποτελεί η απουσία περιεγχειρητικών αρρυθμιών, σε αντίθεση με την ξυλαζίνη. Ιδιαίτερη προσοχή πρέπει να δίνεται όταν χορηγείται δεξμετομιδίνη σε επίμυς, λόγω αυξημένης συχνότητας έμφραξης της ουρήθρας μετά την αναισθησία και θνησιμότητας (Cagle et al. 2017). Η μείωση της αρτηριακής πίεσης, της καρδιακής συχνότητας, της συσπαστικότητας του μυοκαρδίου και της καρδιακής παροχής αποτελούν σημαντικές παρενέργειες των α-2 αδρενεργικών αγωνιστών (Suckow et al. 2012).
Ο συνδυασμός μεδετομιδίνης-μιδαζολάμης-φαιντανύλης έχει χρησιμοποιηθεί επιτυχώς σε τσιντσιλά, ινδικά χοιρίδια, επίμυς, μυς και κρικητούς. Ένα βασικό πλεονέκτημα του συνδυασμού αυτού είναι η πλήρης αναστροφή της αναισθησίας με ατιπαμεζόλη, φλουμαζενίλη και ναλοξόνη αντίστοιχα, μειώνοντας έτσι το χρόνο ανάνηψης και επο- μένως τον κίνδυνο εμφάνισης υποθερμίας και υπογλυκαιμίας. Ο συνδυασμός όμως αυτός απαιτεί ενδοτραχειακή διασωλήνωση και παρακολούθηση της αναπνευστικής λειτουργίας (Henke et al. 2005, Baumgartner et al. 2010). Μέτρια περιφερική αγγειοσύσπαση, η οποία δυσχεραίνει την εισαγωγή ενδοφλέβιου καθετήρα, παρατηρείται κατά τη χορήγηση μεδετομιδίνης. Η ατιπαμεζόλη σε δόση 10- 20% της προαναισθητικής δόσης της μεδετομιδίνης μπορεί να μειώσει τις ανεπιθύμητες ενέργειες, χωρίς παράλληλα να αναστρέφει την αναισθησία και αναλγησία (Carpenter 2005). Η ενδομυϊκή χορήγηση μεδετομιδίνης-μιδαζολάμης-φαιντανύλης στα τσιντσιλά παρέχει αναισθησία για 1,5 ώρα, αλλά η καρδιακή και αναπνευστική συχνότητα μειώνονται και η ανάνηψη είναι παρατεταμένη αν δε γίνει αναστροφή της αναισθησίας.
Η ξυλαζίνη σε συνδυασμό με κεταμίνη, και η δετομιδίνη μόνη ή σε συνδυασμό με κεταμίνη-διαζεπάμη, χορηγούμενες σε επανειλημμένες δόσεις, σχετίζονται με ίνωση και νέκρωση του μυοκαρδίου στον κόνικλο (Hurley et al. 1994).
Εγκατάσταση και διατήρηση αναισθησίας
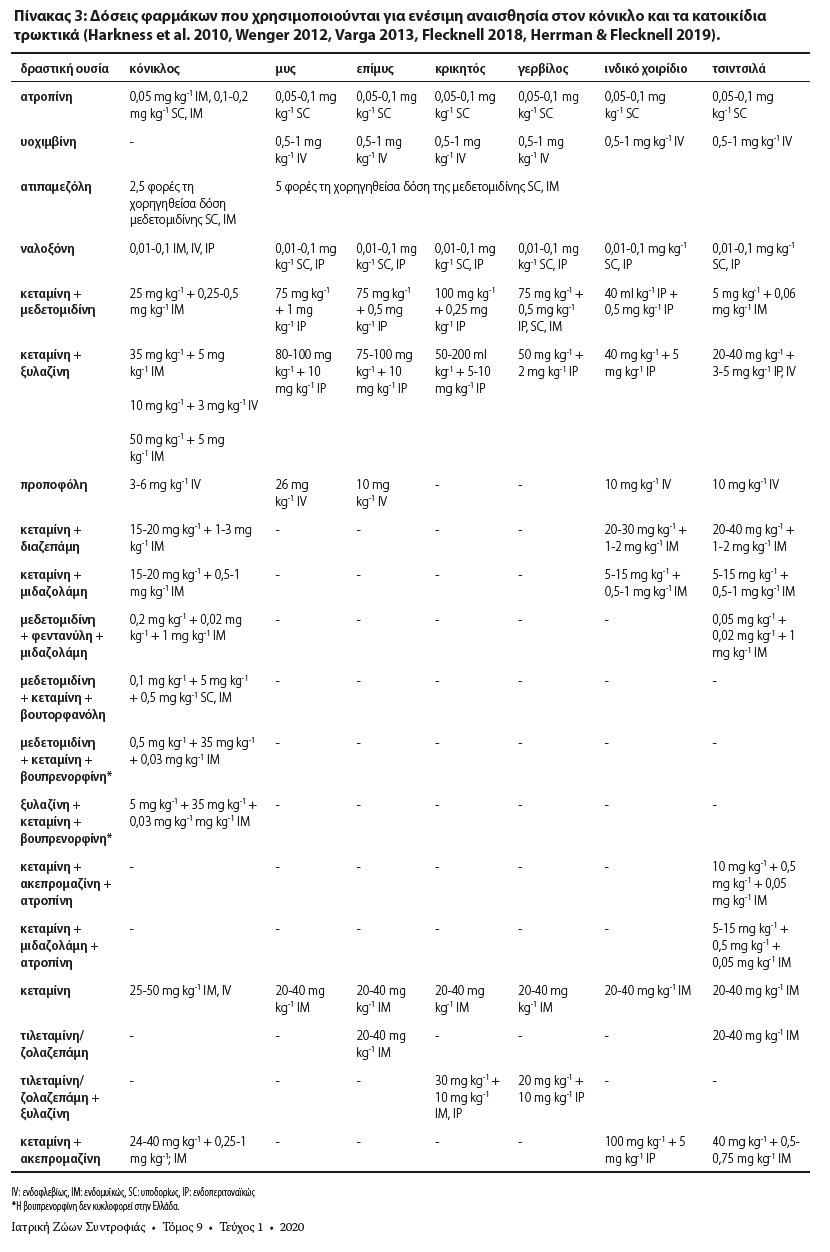
Στον Πίνακα 3 παρουσιάζονται δραστικές ουσίες και συνδυασμοί αυτών που μπορούν να χρησιμοποιηθούν για ενέσιμη αναισθησία στον κόνικλο και τα κατοικίδια τρωκτικά.
Η εγκατάσταση της αναισθησίας μπορεί να επιτευχθεί με ενέσιμα ή εισπνευστικά αναισθητικά. Η χρήση μόνο εισπνευστικών αναισθητικών φαρμάκων δεν είναι πάντα αποτελεσματική και μπορεί να αποβεί επιβλαβής. Αυτό, γιατί τα ζώα αυτά όταν εκτίθενται μόνο στα εισπνευστικά αναισθητικά, έστω και σε μικρές συγκεντρώσεις, υφίστανται στρες και κρατούν την αναπνοή τους μέχρι και για 2 λεπτά. Το έντονο στρες απελευθερώνει κατεχολαμίνες και τα εισπνευστικά αναισθητικά ευαισθητοποιούν το μυοκάρδιο σε αυτές, κατάσταση που μπορεί να οδηγήσει σε καρδιακή ανακοπή (Flecknell 2006).
Τα αναισθητικά κυκλώματα για τη διατήρηση της αναισθησίας πρέπει να έχουν μικρό νεκρό χώρο και χαμηλή αντίσταση, π.χ. κύκλωμα Bain ή Ayre’s T-piece (Wenger 2012). Η εισπνευστική αναισθησία αποτελεί πρώτη επιλογή για την αναισθησία των τρωκτικών. Ωστόσο η διασωλήνωση της τραχείας είναι δύσκολα εφικτή σε αυτά τα είδη (Longley 2008), για αυτό η αναισθησία συχνά διατηρείται με μία προσαρτημένη προσωπίδα, συνδεδεμένη στο αναπνευστικό κύκλωμα (Wenger 2012). Ακόμη, μπορούν να χρησιμοποιηθούν πρωτόκολλα ολικής ενέσιμης αναισθησίας, ή η αναισθησία μπορεί να ενισχυθεί ή να διατηρηθεί χρησιμοποιώντας εισπνευστικά αναισθητικά μετά την εγκατάστασή της με ενέσιμα (Longley 2008).
Στο ινδικό χοιρίδιο και το τσιντσιλά η ενδοτραχειακή διασωλήνωση δυσχεραίνεται από την προσάρτηση της μαλακής υπερώας στη βάση της γλώσσας, η οποία σχηματίζει μια υπερώια κοιλότητα, πλούσια σε αγγείωση, η οποία εύκολα τραυματίζεται (Wenger 2012).
Η διασωλήνωση στον κόνικλο προτείνεται σε όλες τις αναισθητικές διαδικασίες εκτός από τις πολύ σύντομες. Για τη διασωλήνωση μπορεί να χρησιμοποιηθεί η τυφλή τεχνική (ακρόαση για αναπνευστικούς ήχους από την άκρη του τραχειοσωλήνα) ή προβάλλοντας το λάρυγγα με λαρυγγοσκόπιο ή ενδοσκόπιο. Για την εφαρμογή και των δύο τεχνικών ο κόνικλος τοποθετείται σε στερνική κατάκλιση και ο τράχηλος εκτείνεται για να διευκολύνει τη διασωλήνωση. Για την αποφυγή λαρυγγόσπασμου χρησιμοποιείται λιδοκαΐνη τοπικά στο λάρυγγα. Στους επίμυς κυρίως έχει περιγραφεί μια εύκολη και αξιόπιστη τεχνική διασωλήνωσης, με τη χρήση φλεβοκαθετήρα από τεφλόν 22G, του οποίου κόβεται το μεταλλικό άκρο του οδηγού που προεξέχει. Ο επίμυς ακινητοποιείται και ένα ράμμα οδηγείται γύρω από τους άνω τομείς για να διευκολυνθεί η διάνοιξη της γνάθου. Έπειτα με τη βοήθεια μιας πηγής φωτός ο καθετήρας προωθείται με κυκλικές κινήσεις και πιέζοντας την επιγλωττίδα προωθείται προς την τραχεία (Papastefanou et al. 2014). Εναλλακτικά στον κόνικλο μπορεί να χρησιμοποιηθεί λαρυγγική μάσκα, η οποία πλεονεκτεί ως προς την ευκολία της τεχνικής και την απαίτηση μικρότερης ποσότητας αναισθητικού εγκατάστασης για να τοποθετηθεί (Kazakos et al. 2007). Παρόλο που η λαρυγγική μάσκα μπορεί να χρησιμοποιηθεί για τεχνητό αερισμό, υπάρχει πιθανότητα δημιουργίας γαστρικού τυμπανισμού, ιδιαίτερα όταν η μέγιστη εισπνευστική πίεση υπερβεί τα 14 cmH2O (Bateman et al. 2005).
Εισπνευστικά αναισθητικά
Τα συνήθη εισπνευστικά αναισθητικά είναι το ισοφλουράνιο και το σεβοφλουράνιο. Οι συγκεντρώσεις εγκατάστασης που απαιτούνται είναι 3-4,5% για το ισοφλουράνιο και 5-6% για το σεβοφλουράνιο. Ο γερβίλος φαίνεται να απαιτεί μεγαλύτερες συγκεντρώσεις σε σχέση με τα άλλα τρωκτικά (Keeble 2002). Ειδικότερα, η ελάχιστη κυψελιδική συγκέντρωση (MAC) στον κόνικλο χωρίς προαναισθητική αγωγή είναι 2,07% για το ισοφλουράνιο και 2,9-3,2% για το σεβοφλουράνιο. Σε κονίκλους που ταυτόχρονα λάμβαναν κεταμίνη 0,4-1 mg kg-1 hr-1 ή λιδοκαΐνη 3-6 mg kg-1 hr-1), το MAC είναι αντίστοιχα 1,5% για το ισοφλουράνιο και 2,1% για το σεβοφλουράνιο (Flecknell 2006, Barter & Epstein 2013, Schnellbacher et al. 2013).
Τα εισπνευστικά αναισθητικά δεν παρέχουν αναλγησία, γιαυτό πρέπει να χορηγούνται παράλληλα και αναλγητικά κατά περίπτωση. Η χορήγηση οξυγόνου πριν την εγκατάσταση της αναισθησίας βελτιώνει την αιμάτωση και τον κορεσμό των ιστών σε οξυγόνο, πράγμα ιδιαίτερα χρήσιμο σε ασθενείς με προϋπάρχουσα καρδιακή ή αναπνευστική νόσο (Longley 2008). Επιπλέον, για να προληφθεί το κράτημα της αναπνοής, αρχικά πρέπει να χορηγείται αποκλειστικά οξυγόνο και σταδιακά να αυξάνεται η χορήγηση του εισπνευστικού αναισθητικού. Στο ινδικό χοιρίδιο, το κράτημα της αναπνοής, είναι τόσο έντονο, ώστε δεν πρέπει να χρησιμοποιείται αναισθητικός θάλαμος για εγκατάσταση. Τονίζεται ότι το κράτημα της αναπνοής μπορεί να οδηγήσει σε ξαφνική, βαθιά εισπνοή αναισθητικού που ακολουθείται από καρδιακή και αναπνευστική παύση (Flecknell et al 1996).
Στον κόνικλο συχνά προτιμάται το σεβοφλουράνιο για ταχεία εγκατάσταση, η οποία φαίνεται να είναι αρκετά ανεκτή από το ζώο και δεν ευαισθητοποιεί το μυοκάρδιο στην αρρυθμογόνο δράση των κατεχολαμινών, σε περίπτωση στρες (Piriou et al. 2002). Στα τρωκτικά, η ανάνηψη από το σεβοφλουράνιο είναι ήρεμη. Οι διαφορές στους χρόνους εγκατάστασης και ανάνηψης της αναισθησίας σε σχέση με το ισοφλουράνιο είναι μικρές (Preckel et al. 2005). Στο ινδικό χοιρίδιο το ισοφλουράνιο συχνά προκαλεί δακρύρροια και σιαλόρροια (Schmitz et al. 2016).
Αν και το σεβοφλουράνιο φαίνεται να είναι λιγότερο ερεθιστικό, συνεχίζουν να παράγονται εκκρίσεις από το ανώτερο αναπνευστικό. Είναι δυνατόν επίσης, να γίνει εγκατάσταση με σεβοφλουράνιο και διατήρηση με ισοφλουράνιο, για οικονομικούς λόγους (Allweiler 2010).
Ενέσιμα αναισθητικά
Προποφόλη
Η προποφόλη μπορεί να χρησιμοποιηθεί στον κόνικλο, με ή χωρίς προνάρκωση, για τη διασωλήνωση της τραχείας. Η προποφόλη στα ζώα αυτά μπορεί να προκαλέσει άπνοια, υποξία και υπόταση. Η βραδεία χορήγησή της (μέσα σε πάνω από 60 sec η κάθε δόση για εγκατάσταση), προς αποφυγή άπνοιας και ομαλή εγκατάσταση της αναισθησίας είναι μείζονος σημασίας (Allweiler 2010). Η προποφόλη όμως δεν είναι χρήσιμη για διατήρηση της αναισθησίας σε μακράς διάρκειας επώδυνες χειρουργικές επμβάσεις, καθώς προκαλεί μικρού βάθους αναισθησία χωρίς αναλγησία (Wenger 2012). Η χρήση της είναι περιορισμένη στα τρωκτικά, επειδή η ενδοφλέβια πρόσβαση στα ζώα αυτά δύσκολα επιτυγχάνεται. Επιπλέον, η άπνοια που προκαλεί η προποφόλη μπορεί να αποτελέσει μεγάλο πρόβλημα, λόγω της δυσκολίας χορήγησης της δόσης αργά σε ζώα μικρού μεγέθους (Flecknell 2006) καθώς και της δυσκολίας ελέγχου του αεραγωγού.
Κεταμίνη
Η κεταμίνη μπορεί να χορηγηθεί ενδομυϊκά, υποδόρια, ενδοπεριτοναϊκά και ενδοφλέβια και έχει ήπια αναλγητική δράση (Hedenqvist et al. 2002). Όταν η κεταμίνη χορηγείται σε συνδυασμό με μεδετομιδίνη, ξυλαζίνη ή διαζεπάμη σε μια έγχυση, είναι πολύ αποτελεσματική για την εγκατάσταση χειρουργικής αναισθησίας στον κόνικλο και τα κατοικίδια τρωκτικά (Flecknell 2016). Ειδικά στον κόνικλο, μπορεί να χορηγηθεί μαζί με προποφόλη, συνδυασμός που έχει δοσοεξαρτώμενη δράση και απαιτεί ταυτόχρονη χορήγηση οξυγόνου (Santos et al. 2016).
Χορηγούμενη μόνη στα τρωκτικά, η κεταμίνη προκαλεί μάλλον ακινησία παρά χειρουργική αναισθησία. Στα μικρόσωμα τρωκτικά, οι υψηλές δόσεις που απαιτούνται για την εξασφάλιση χειρουργικής αναισθησίας προκαλούν σοβαρή αναπνευστική καταστολή. Η ανάνηψη μπορεί να είναι παρατεταμένη και πιθανόν να συνοδεύεται από διέγερση και παραισθήσεις (Flecknell 2016). Η ενδομυϊκή χορήγησή της έχει ενοχοποιηθεί για αυτοακρωτηριασμό στον κόνικλο (Shientag 2011, Wenger 2012).
Η κεταμίνη συχνά συνδυάζεται με μεδετομιδίνη ή ξυλαζίνη για χημική συγκράτηση και χειρουργική αναισθησία βραχείας διάρκειας, χορηγούμενη με μία έγχυση, συνήθως ενδοπεριτοναϊκά. Στον κόνικλο, ο συνδυασμός κεταμίνης-μεδετομιδίνης επιτρέπει την ταχεία διασωλήνωση της τραχείας, χρήση ισοφλουρανίου σε μικρότερες συγκεντρώσεις και μικρότερη απώλεια θερμότητας, συγκριτικά με το συνδυασμό κεταμίνης-μιδαζολάμης, αλλά συχνά ευθύνεται για την πρόκληση λαρυγγόσπασμου (Grint et al. 2008). Ο συνδυασμός κεταμίνης-μεδετομιδίνης παρέχει επίσης καλύτερη ποιότητα και μεγαλύτερη διάρκεια αναισθησίας σε υγιείς κονίκλους από ότι ο συνδυασμός μεδετομιδίνης-μιδαζολάμης-φαιντανύλης. Μπορεί όμως να προκαλέσει σημαντική πτώση του αρτηριακού pH και της μερικής πίεσης του οξυγόνου, με συνέπεια την μετεγχειρητική άπνοια. Ευθύνεται επίσης για την πτώση θερμοκρασίας κατά 4-4,6°C σε μυς, επίμυς και κρικητούς (Cruz et al. 1998, Longley 2008).
Η επίδραση των α-2 αδρενεργικών αγωνιστών σε συνδυασμό με την κεταμίνη φαίνεται να είναι λιγότερο κατασταλτική στα ινδικά χοιρίδια, τα οποία μπορεί να μην αναισθητοποιηθούν επαρκώς (Quesenberry & Carpenter 2012). Σε κάθε περίπτωση η εγκατάσταση της αναισθησίας με κεταμίνη-ξυλαζίνη είναι απαραίτητη πριν από τη χορήγηση οποιουδήποτε εισπνευστικού αναισθητικού.
Προκειμένου να ελαττωθούν οι εκκρίσεις των βρόγχων και των σιαλογόνων αδένων απαιτείται σε κάποιες περιπτώσεις η χορήγηση ατροπίνης (ή γλυκοπυρρολάτης) (Flecknell 2016).
Τιλεταμίνη-ζολαζεπάμη
Ο συνδυασμός τιλεταμίνης-ζολαζεπάμης κυκλοφορεί στην Ελλάδα με το εμπορικό σκεύασμα Zoletil. Η τιλεταμίνη έχει παρόμοια χημική σύνθεση με την κεταμίνη. Η ζολαζεπάμη είναι μία βενζοδιαζεπίνη φαρμακολογικά παρόμοια με τη διαζεπάμη. Η ζολαζεπάμη εντείνει τη δράση της τιλεταμίνης στο κεντρικό νευρικό σύστημα και προφυλάσσει επίσης από επιληπτικές κρίσεις που μπορεί να προκαλέσει η τιλεταμίνη, ενώ βελτιώνει τη μυοχάλαση και την ανάνηψη από την αναισθησία.
Στους επίμυς, χρησιμοποιείται σε συνδυασμό με ξυλαζίνη προκαλώντας καταστολή του καρδιαγγειακού συστήματος και σε συνδυασμό με βουτορφανόλη με μικρή κατασταλτική δράση στο κυκλοφορικό και αναπνευστικό σύστημα (Wilson et al. 1993).
Αντενδείκνυται στον κόνικλο επειδή μπορεί να προκαλέσει νεφροτοξικότητα (Doerning et al. 1992).
Ανάνηψη και μετεγχειρητική φροντίδα
Κατά τη μετεγχειρητική περίοδο πρέπει να συνεχίζονται τα υποστηρικτικά μέτρα και η παρακολούθηση του ζώου. Η θερμοκρασία περιβάλλοντος πρέπει να διατηρείται, αρχικά περίπου στους 35°C και στη συνέχεια, καθώς το ζώο επανακτά συνείδηση, η θερμοκρασία μπορεί να ελαττωθεί στους 26-28°C (Caro et al. 2013). Στα ζώα πρέπει να παρέχεται θερμό και άνετο δάπεδο. Το πριονίδι δεν είναι κατάλληλο ενώ προτιμόνται πέλετς ή ξηρή στρωμνή για την αρχική περίοδο ανάνηψης. Στη συνέχεια, εφόσον το ζώο έχει ανακτήσει δραστηριότητα, μπορεί να μεταφερθεί σε κλωβό ή περιφραγμένο χώρο με κομμάτια εφημερίδας (μύες, επίμυες) ή καλής ποιότητας σανό ή άχυρο (τσιντσιλά, ινδικά χοιρίδια). Τα αμμόλουτρα των τσιντσιλά πρέπει να απομακρύνονται έως ότου τα ζώα έχουν ανανήψει πλήρως, αλλιώς μπορεί να προκληθούν οφθαλμικά τραύματα ή εισπνοή σκόνης (Cantwell 2001, Flecknel 2006).
Σε όλα τα είδη συνιστάται η παρεντερική χορήγηση θερμού (37°C) διαλύματος δεξτρόζης ή/και φυσιολογικού ορού (1-2 ml NaCl 0,9% ανά 100 g σωματικού βάρους SC) κατά το πέρας της επέμβασης, ως υποστήριξη με υγρά για τη μετεγχειρητική περίοδο (Flecknel 2006, Hoff et al. 2006).
Η πρόσληψη τροφής πρέπει να ενθαρρύνεται όσο το δυνατόν συντομότερα μετά την ανάνηψη. Οι μύες και οι επίμυες μπορεί να προτιμήσουν τροφή μαλακής σύστασης, ενώ οι κόνικλοι και τα ινδικά χοιρίδια καταναλώνουν πέλετς, χόρτο ή ειδική τροφή εμπορίου σε μορφή πολτού για ζώα με αυξημένες ανάγκες μετεγχειρητικά. Για την αποφυγή μετεγχειρητικού ειλεού πρέπει να χορηγούνται προκινητικά φάρμακα (μετοκλοπραμίδη 0,2-1 mg kg-1, PO, SC ή IM, κάθε 12 ώρες). Στον επίμυ είναι αποτελεσματικά και τα μη στεροειδή αντιφλεγμονώδη φάρμακα, τα οποία βοηθούν έμμεσα μειώνοντας το μετεγχειρητικό στρες και τον πόνο. Σε έρευνες μάλιστα έχει φανεί ότι επαναλαμβανόμενη χορήγηση μη στεροειδών αντιφλεγμονωδών φαρμάκων, όπως η μελοξικάμη, παρέχει καλύτερο βαθμό αναλγησίας από ότι τα οπιοειδή (Cooper et al. 2009, Bourque et al. 2010). Ιδιαίτερα σημαντική παρατήρηση είναι αυτά τα ζώα πρέπει να νοσηλεύονται μακριά από θέα, ήχους ή οσμή θηρευτών, όπως είναι οι γάτες και οι σκύλοι.
Σύγκρουση συμφερόντων
Οι συγγραφείς δηλώνουν ότι δεν υπάρχει σύγκρουση συμφερόντων.
Βιβλιογραφία
- Alibhai, HK, Clarke KW, Lee YH, Thompson J (1996) Cardiopulmonary effects of combinations of medetomidine hydrochloride and atropine sulphate in dogs. Vet Rec 138, 11–13.
- Allweiler S, Leach MC, Flecknell PA (2010) The use of propofol and sevoflurane for surgical anaesthesia in New Zealand White rabbits. Lab Anim 44, 113–117.
- Bateman L, Ludders JW, Gleed RD, Erb HN (2005) Comparison between facemask and laryngeal mask airway in rabbits during isoflurane anesthesia. Vet Anaesth Analg 32, 280-288.
- Barr J (2007) Reversal Agents: Naloxone and Flumazenil. Complications in Anesthesia, 2nd ed, (Saunders Elsevier, Philadelphia) pp. 128- 130.
- Barter LS, Epstein SE (2013) Cardiopulmonary effects of three concentrations of isoflurane with or without mechanical ventilation and supramaximal noxious stimulation in New Zealand white rabbits. Am J Vet Res 74, 1274-1280.
- Baumgartner C, Bollerhey M, Ebner J, Laacke-Singer L, Schuster T, Erhardt W (2010) Effects of ketamine-xylazine intravenous bolus injection on cardiovascular function in rabbits. Can J Vet Res, 74, 200-208.
- Boehm Β, Carney Ε, Tallarida Ρ, Wilson Ρ (2010) Midazolam enhances the analgesic properties of dexmedetomidine in the rat, Vet Anesth Analg 37, 550-556.
- Bourque SL, Adams MA, Nakatsu K (2010) Comparison of buprenorphine and meloxicam for post-surgical analgesia in rats: effects on body weight, locomotor activity. J Am Assoc Lab Anim Sci 49, 617–622.
- Brodbeld D (2009) Perioperative mortality in small animal anaesthesia. Vet J 182, 152-160.
- Cagle L, Franzi L, Epstein S, Kass P, Last J, Kenyon N (2017) Injectable Anesthesia for Mice: Combined Effects of Dexmedetomidine, Tiletamine-Zolazepam, and Butorphanol, Anesthesiol Res Pract, ID: 9161040. pp.1-7.
- Cantwell SL (2001) Ferret, rabbit, and rodent anesthesia. Veterinary Clin North Am Exotic Animal Practice 4, 169-191.
- Caro AC, Hankenson FC, Marx JO (2013) Comparison of thermoregulatory devices used during anesthesia of C57BL/6 mice and correlations between body temperature and physiologic parameters. J Am Assoc Lab Anim Sci 52, 577-583.
- Carpenter JW (2005) Ferrets. Exotic Animal Formulary. 3rd ed. Elsevier Health Science, (London, United Kingdom) pp. 447–476.
- Cooper C, Metcalf-Pate K, Barat K, Cook J, Scorpio D (2009) Comparison of Side Effects between Buprenorphine and Meloxicam Used Postoperatively in Dutch Belted Rabbits (Oryctolagus cuniculus). J Am Assoc Lab Anim Sci 48, 279–285.
- Crotaz I R (2010). Initial feasibility investigation of the v-gel airway: an anatomically 9 / 10 designed supraglottic airway device for use in companion animal veterinary anaesthesia. Vet Anaesth Analg 37, 579-580.
- Cruz F and Junquera J (1993) The immobility response elicited by clamping, bandaging and grasping in the Mongolian gerbil (Meriones unguiculatus). Behav Brain Res 54, 165-169.
- Doerning BJ, Brammer DW, Chrisp CE, Rush HG (1992) Nephrotoxicity of tiletamine in New Zealand white rabbits. Lab Anim Science 42, 267-269.
- Flecknell P (2006) Anaesthesia and perioperative care. In: Meredith A, Flecknell P, editors. BSAVA Manual of Rabbit Medicine and Surgery. Quedgeley, UK, pp. 154–65.
- Flecknell P (2016) Laboratory Animal Anaesthesia, 4th ed., Academic Press, (Newcastle, UK)
- Fox L, Snyder L, Mans C (2016) Comparison of dexmedetomidine– ketamine versus isoflurane anesthesia in chinchillas (Chinchilla lanigera). J Am Assoc Lab Anim Sci 55, 1–5.
- Flecknell P (2018) Rodent analgesia: Assessment and therapeutics. Vet J 232, 70-77.
- Ghaffari MS, Moghaddassi AP, Bokaie S (2009) Effects of intramuscular acepromazine and diazepam on tear production in rabbits. Vet Rec 164, 147-148.
- Goodman G (2002) Hamster. In: BSAVA manual of exotic pets. (4th edn), BSAVA, Hampshire, pp. 27-33.• Grint NJ, Murison PJ (2008) A comparison of ketamine-midazolam and ketamine-medetomidine combinations for induction of anaesthesia in rabbits. Vet Anaesth Analg 35, 113-121.
- Harkness JE, Turner PV, Woude S, Wheler CL (2010) Harkness and Wagner’s Biology and Medicine of Rabbits and Rodents, 5th edn. Wiley-Blackwell, Iowa, pp. 147-239.
- Hedenqvist P, Orr HE, Roughan JV, Antunes LM, Flecknell PA (2002) Anaesthesia with ketamine/medetomidine in the rabbit: influence of route of administration and the effect of combination with butorphanol. Vet Anaesth Analg 29, 14-19.
- Henke J, Astner S, Brill T, Eissner B, Busch R, Erhardt W (2005) Comparative study of three intramuscular anaesthetic combinations (medetomidine/ketamine, medetomidine/fentanyl/ midazolam and xylazine/ ketamine) in rabbits. Vet Anaesth Analg 32, 261-270.
- Herrmann K and Flecknell P (2019) Retrospective review of anesthetic and analgesic regimens used in animal research proposals. ALTEX - Alternatives to animal experimentation 36, 65-80.
- Hoefer HL, Crossley DA (2002) Chincillas. In: BSAVA manual of exotic pets. (4th edn), BSAVA, Hampshire, pp. 65-75.
- Hoff JB, Dysko R, Kurachi S, Kurachi K (2006) Technique for performance and evaluation of parapharyngeal hypophysectomy in mice. J Am Assoc Lab Anim Sci 45, 57-62.
- Horn C, Kimball B, Wang H, Kaus J, Dienel S, Nagy A, Gathright G, Yates B, Andrews P (2013) Why Can’t Rodents Vomit? A Comparative Behavioral, Anatomical, and Physiological Study, PLoS One 8, 101-171.
- Hurley RJ, Marini RP, Avison DL, Murphy JC, Olin JM, Lipman NS (1994) Evaluation of detomidine anesthetic combinations in the rabbit. Lab Anim Science 5, 472-478.
- Johnson-Delaney C (2016) Ferret Medicine and Surgery, CRC Press, Washington, pp. 312-407.
- Kazakos GM, Anagnostou T, Savvas I, Raptopoulos D, Psalla D, Kazakou IM (2007) Use of the laryngeal mask airway in rabbits: placement and efficacy. Lab Anim 36, 29-34.
- Keeble E (2002) Gerbils. In: Meredith A and Redrobe S (eds), BSAVA Manual of Exotic Pets (4th edn), BSAVA. pp. 34-46.
- Kohn DF, Martin TE, Foley PL, Morris TH, M Swindle M, Vogler GA, Wixson S (2007) Guidelines for the Assessment and Management of Pain in Rodents and Rabbits, J Am Ass Lab Anim Science 46, 97-108.
- Longley L (2008) Anaesthesia of Exotic Pets. Elsevier, Philadelphia.
- Orr HE (2002) Rats and Mice. In: BSAVA manual of exotic pets. (4th edn), BSAVA, Hampshire, pp. 16-17.
- Papastefanou A, Balafas E, Duracevic S, Kostomitsopoulos N (2014) A simple method of endotracheal intubation in mice. Arch Biol Sci 66, 241-244.
- Papich MG (2016) Diazepam. Saunders Handbook of Veterinary Drugs, pp. 228–229.
- Phaneuf L R, Barker S, Groleau M A and Turner P V (2006) Tracheal injury after endotracheal intubation and anaesthesia in rabbits. J Am Assoc Lab Anim Sci 45, 67-72.
- Piriou V, Chiari P, Lhuillier F, Bastien O, Loufoua J, Raisky O, David JS, Ovize M, Lehot JJ (2002) Pharmacological preconditioning: comparison of desflurane, sevoflurane, isoflurane and halothane in rabbit myocardium 89, 486-491.
- Preckel B, Bolten J (2005) Pharmacology of modern volatile anaesthetics, Best Practice and Research. Clin Anaesthesiol 19, 331–348.
- Quesenberry K and Carpenter J (2012) Ferrets, Rabbits, and Rodents, Clinical Medicine and Surgery, 3rd ed, Elsevier, Missouri, pp. 429-451.
- Quiroz-Padilla MF, Guillazo-Blanch G, Sanchez MY, Dominguez- Sanchez MA, Gomez RM (2018) Effects of Excitotoxic Lesion with Inhaled Anesthetics on Nervous System Cells of Rodents. Curr Pharm 24, 4-14.
- Richardson CA & Flecknell PA (2005) Anaesthesia and Postoperative Analgesia following Experimental Surgery in Laboratory Rodents: Are we Making Progress? Alternatives to Laboratory Animals 33, 119–127.
- Santangelo B, Micieli F, Marino F, Reynaud F, Cassandro P, Carfora A, Petrella R, Borriello R, Cataldi M, Vesce G (2016) Plasma concentrations and sedative effects of a dexmedetomidine, midazolam, and butorphanol combination after transnasal administration in healthy rabbits. J Vet Pharmacol Ther 39, 408-411.
- Santos M, Viñuela A, Vela A, Tendillo FJ (2016) Single-syringe ketamine-propofol for induction of anaesthesia in rabbits. Vet Anaesth Analg 43, 561-565.
- Schernthaner A, Lendl C, Hartmann K, Pragst I, Preissel AK, Henke J (2011) Medetomidine/ midazolam/ ketamine anaesthesia in ferrets: effects on cardiorespiratory parameters and evaluation of plasma drug concentrations, J Vet Anesth Analg 38, 439-450.
- Schmitz S, Tacke S, Guth B, Henke J (2016). Comparison of Physiological Parameters and Anaesthesia Specific Observations during Isoflurane, Ketamine-Xylazine or Medetomidine- Midazolam-Fentanyl Anaesthesia in Male Guinea Pigs. PLoS One 11, e0161258, 1-22.
- Schnellbacher R, Carpenter JW, Mason D, KuKanich B, Hugues Beaufrère H, Boysen C (2013) Effects of lidocaine administration via continuous rate infusion on the minimum alveolar concentration of isoflurane in New Zealand White rabbits (Oryctolagus cuniculus). Am J Vet Res 74, 1377-1384.
- Shientag LJ, Goad M, (2011) Sudden hind limb injuries in two rabbits. Self-mutilation after intramuscular ketamine-related neuronal injury. Lab Anim 21, 212-216.
- Szreder Ζ (1993) Comparison between thermoregulatory effects mediated by alpha 1- and alpha 2-adrenoceptors in normothermic and febrile rabbits. Gen Pharmacol 24, London, UK.
- Suckow MA, Stevens KA, Wilson RP (2012) The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. American College of Laboratory Animal Medicine Series. Academic Press. Elsevier, Netherlands, pp. 36-38.
- Varga M (2013) Textbook of Rabbit Medicine. 2nd Ed, Butterworth- Heinemann, Toronto, pp. 178-203.
- Wenger S (2012) Anesthesia and analgesia in rabbits and rodents. J Exotic Pet Med 21, 7–16.
- Wilson R, Zagon I, Larach D, Lang M (1993) Cardiovascular and respiratory effects of tiletamine-zolazepam. Pharm Bioch Behavior 44, 1-8.
Υπεύθυνη αλληλογραφίας:
Παναγιώτα Καραμιχάλη
e-mail: Αυτή η διεύθυνση ηλεκτρονικού ταχυδρομείου προστατεύεται από τους αυτοματισμούς αποστολέων ανεπιθύμητων μηνυμάτων. Χρειάζεται να ενεργοποιήσετε τη JavaScript για να μπορέσετε να τη δείτε.



