Murphy K.R. Biomedical and Veterinary Sciences, Virginia-Maryland College of Veterinary Medicine, Blacksburg, VA, USA
Hay A.N. Department of Small Animal Clinical Sciences, Virginia-Maryland College of Veterinary Medicine, Blacksburg, VA, USA
Rossmeisl Jr. J.H. Department of Small Animal Clinical Sciences, Virginia-Maryland College of Veterinary Medicine, Blacksburg, VA, USA
Klahn S. Department of Small Animal Clinical Sciences, Virginia-Maryland College of Veterinary Medicine, Blacksburg, VA, USA
Vlaisavljevich E. Department of Biomedical Engineering and Mechanics, Virginia Polytechnic Institute and State University, Blacksburg, VA, USA
Tuohy J. Department of Small Animal Clinical Sciences, Virginia-Maryland College of Veterinary Medicine, Blacksburg, VA, USA
Davalos R.V. Department of Biomedical Engineering and Mechanics, Virginia Polytechnic Institute and State University, Blacksburg, VA, USA / Department of Mechanical Engineering, Virginia Polytechnic Institute and State University, Blacksburg, VA, USA / Virginia Tech-Wake Forest University, School of Biomedical Engineering and Sciences, Blacksburg, VA, USA
Coutermarsh-Ott S. Department of Biomedical Sciences and Pathobiology, Virginia-Maryland College of Veterinary Medicine, Blacksburg, VA, USA
Dervisis N.G. Department of Small Animal Clinical Sciences, Virginia-Maryland College of Veterinary Medicine, Blacksburg, VA, USA / Department of Internal Medicine, Virginia Tech Carilion School of Medicine, Roanoke, VA, USA
Λέξεις ευρετηρίου:
γάτα, ελάχιστα επεμβατικές μέθοδοι, καρκίνος, σκύλος
Περίληψη
Ο καρκίνος στα ζώα συντροφιάς παραμένει ο μεγαλύτερος παράγοντας θνησιμότητας, με τα περιστατικά καρκίνου να αυξάνονται, καθώς η μακροζωία των ζώων συντροφιάς συνεχίζει να βελτιώνεται. Η χημειοθεραπεία, η ακτινοθεραπεία και η χειρουργική επέμβαση είναι οι κύριες μέθοδοι θεραπείας του καρκίνου στην κτηνιατρική, αλλά οι θεραπείες αυτές έχουν σημαντικούς περιορισμούς. Ως αποτέλεσμα των περιορισμών των σημερινών θεραπευτικών μεθόδων, δίνεται ιδιαίτερη προσοχή στην ανάπτυξη ελάχιστα επεμβατικών θεραπευτικών μεθόδων για τη θεραπεία των καρκίνων των ζώων συντροφιάς, προκειμένου να περιοριστεί η νοσηρότητα, να βελτιωθεί ο έλεγχος του όγκου και να προληφθούν οι μεταστάσεις. Ειδικότερα, η ενεργειακή κατάλυση του όγκου αποτελεί ελκυστικό μέσο για την ελάχιστα επεμβατική εξάλειψη του καρκινικού ιστού, τόσο μέσω θερμικών όσο και μη θερμικών μηχανισμών. Στο παρόν άρθρο, διερευνούμε τις αρχές, τη μεθοδολογία και τις εφαρμογές διαφόρων θερμικών και μη θερμικών θεραπευτικών μεθόδων κατάλυσης του καρκίνου σε ζώα συντροφιάς. Συγκεκριμένα, εξετάζουμε τους θερμικούς τρόπους κατάλυσης, συμπεριλαμβανομένων της κρυοπηξίας, του εστιασμένου υπερήχου υψηλής έντασης (HIFU), της κατάλυσης με λέιζερ, της κατάλυσης με μικροκύματα και της κατάλυσης με ραδιοσυχνότητες, καθώς και τους μη θερμικούς τρόπους κατάλυσης, συμπεριλαμβανομένων της ιστοθριψίας, της μη αναστρέψιμης ηλεκτροδιάτρησης (IRE) και της μη αναστρέψιμης ηλεκτροδιάτρησης υψηλής συχνότητας (H-FIRE), και αξιολογούμε τις κλινικές εφαρμογές του καθενός στην ογκολογία μικρών ζώων.
Εισαγωγή
Ο καρκίνος αποτελεί τον μεγαλύτερο παράγοντα θνησιμότητας στους σκύλους συντροφιάς, και εν μέρει λόγω της αυξημένης μακροζωίας των ζώων συντροφιάς, η συχνότητα εμφάνισης νεοπλασίας στα ζώα συντροφιάς συνεχίζει να αυξάνεται (Vascellari et al. 2009). Οι βασικοί άξονες της θεραπείας του καρκίνου στα ζώα συντροφιάς περιλαμβάνουν την χειρουργική επέμβαση, την χημειοθεραπεία και την ακτινοθεραπεία. Ωστόσο, η χειρουργική εκτομή συχνά αποκλείεται λόγω του αυξημένου κινδύνου νοσηρότητας και των πιθανών επιπλοκών της ανάρρωσης. Ενώ η χημειοθεραπεία και η ακτινοθεραπεία χρησιμοποιούνται συχνά σε μια προσπάθεια να αποτραπούν οι μεταστάσεις, να αντιμετωπιστούν τα κλινικά συμπτώματα και να ξεπεραστούν οι περιορισμοί της χειρουργικής περίθαλψης, οι μεταστάσεις των πρωτοπαθών όγκων παραμένουν μια σημαντική αιτία θανάτου στους κτηνιατρικούς ασθενείς. Κατά συνέπεια, απαιτούνται επειγόντως βελτιωμένες στρατηγικές θεραπείας του καρκίνου για τη βελτίωση της διαχείρισης της νεοπλασματικής νόσου στην κτηνιατρική.
Ιδιαίτερο ενδιαφέρον αποδίδεται στην ανάπτυξη ελάχιστα επεμβατικών θεραπευτικών μεθόδων σε μια προσπάθεια να περιοριστεί η νοσηρότητα και ταυτόχρονα να μεγιστοποιηθεί ο έλεγχος του όγκου και να αποφευχθούν οι μεταστάσεις σε ασθενή από καρκίνο ζώα συντροφιάς. Συγκεκριμένα, η ενεργειακή κατάλυση του όγκου αναδεικνύεται ως μια ρεαλιστική, αποτελεσματική και δυνητικά οικονομικά αποδοτική παρέμβαση για τον καρκίνο στα ζώα συντροφιάς.
Τι είναι η κατάλυση όγκων με βάση την ενέργεια;
Οι θεραπείες αφαίρεσης όγκων με βάση την ενέργεια περιλαμβάνουν την εστιακή εφαρμογή ενέργειας για την καταστροφή των όγκων, με στόχο την εξάλειψη όλων των νεοπλασματικών κυττάρων εντός ενός καθορισμένου όγκου-στόχου, ενώ παράλληλα προστατεύονται οι γύρω υγιείς ιστοί. Αυτές οι μέθοδοι κατάλυσης εφαρμόζονται μη- ή ελάχιστα επεμβατικά, με απεικονιστική καθοδήγηση, και μπορούν να χρησιμοποιηθούν ως μοναδικές μέθοδοι θεραπείας ή ως βοηθητικά μέσα στην χειρουργική επέμβαση, την χημειοθεραπεία και την ακτινοθεραπεία. Ανάλογα με τη χρησιμοποιούμενη μέθοδο κατάλυσης, η θεραπεία μπορεί να προκαλέσει θερμική (Εικόνα 1Α) ή μη θερμική (Εικόνα 1Β) καταστροφή του ιστού του όγκου. Εδώ, διερευνούμε τους μηχανισμούς, τα πλεονεκτήματα και τους περιορισμούς, καθώς και τις πιο σύγχρονες εφαρμογές καθεμιάς από τις διάφορες μεθόδους θερμικής και μη θερμικής ενεργειακής κατάλυσης όγκων στην κτηνιατρική.
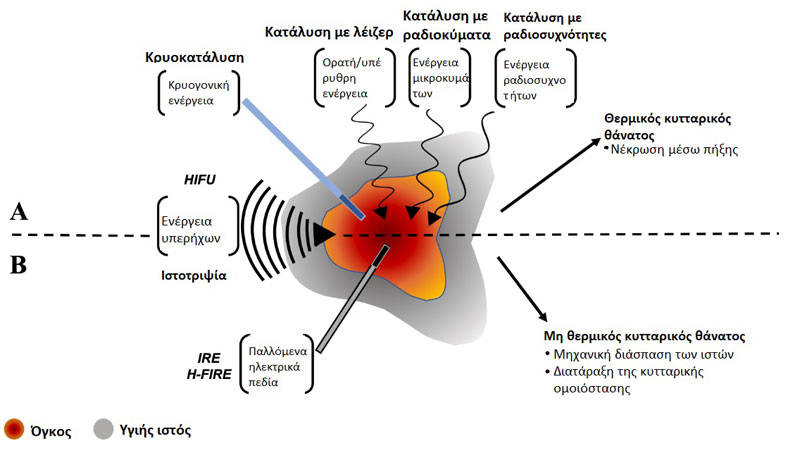
Σχήμα 1. Σύνοψη Α) των θερμικών και Β) των μη θερμικών μεθόδων κατάλυσης με βάση την ενέργεια. Α) Η θερμική κατάλυση του καρκινικού ιστού μπορεί να επιτευχθεί μέσω υποθερμικών μηχανισμών με εφαρμο γή κρυογονικής ενέργειας ή μέσω υπερθερμικών μηχανισμών με εφαρμογή εστιασμένων υπερήχων υψηλής έντασης (HIFU) ή διαφόρων συχνοτήτων ηλεκτρομαγνητικής ενέργειας (κατάλυση με λέιζερ, κατάλυση με μικροκύματα, κατάλυση με ραδιοσυχνότητες). Β) Η μη-θερμική εκτομή του καρκινικού ιστού μπορεί να επιτευχθεί μέσω μηχανικής διάσπασης του ιστού με εφαρμογή μηχανικών εστιασμένων υπερήχων υψηλής έντασης (ιστοθριψία), ή μέσω διαταραχής της κυτταρικής ομοιόστασης μετά από θεραπεία με παλμικά ηλεκτρικά πεδία κατά την μη αναστρέψιμη ηλεκτροδιάτρηση (IRE) και την μη αναστρέψιμη ηλεκτροδιάτρηση υψηλής συχνότητας (H-FIRE).
Κατάλυση του όγκου μέσω θερμικής ενέργειας
Οι θερμικές μέθοδοι κατάλυσης όγκων μπορούν να έχουν κυτταροτοξική δράση μέσω υποθερμικών ή υπερθερμικών μηχανισμών για την πρόκληση νέκρωσης των ιστών. Οι μέθοδοι θερμικής κατάλυσης όγκων περιλαμβάνουν την κρυοπηξία, την κατάλυση με λέιζερ, την κατάλυση με μικροκύματα (MWA), την κατάλυση με ραδιοσυχνότητες (RFA) και την κατάλυση με υπερήχους υψηλής έντασης (HIFU).
Κρυοπηξία
Η κρυοπηξία χρησιμοποιεί υποθερμικούς μηχανισμούς για την πρόκληση ψυχρού τραυματισμού με σκοπό την κυτταροτοξικότητα. Κατά τη διάρκεια της διαδικασίας, ένα υγροποιημένο κρυογόνο αέριο, πιο συχνά αργό, ψύχει έναν καθετήρα, προκαλώντας τη μεταφορά θερμότητας από τον ιστό στον κρυοθετήρα. Το ήλιο υψηλής πίεσης στον κρυοκαθετήρα χρησιμοποιείται στη συνέχεια για την επαναλαμβανόμενη ψύξη και απόψυξη του ιστού. (Hinshaw et al. 2014). Η θερμοκρασία που απαιτείται για να προκληθεί κρυοπηξία ιστών είναι -20 έως -40°C, και οι θερμοκρασίες αυτές πρέπει να εκτείνονται τουλάχιστον 1 cm πέρα από τα όρια του όγκου προκειμένου να εξαλειφθεί πλήρως ο όγκος. Η κρυοπηξία επιδρά στους ιστούς μέσω άμεσης κυτταρικής βλάβης μέσω σχηματισμού σφαιριδίων πάγου και πηκτικής νέκρωσης, ανοσοτροποποίησης , αγγειακής βλάβης και ισχαιμίας. (Erinjeri & Clark 2010).
Η κρυοπηξία επιτρέπει την εύκολη απεικόνιση της σφαίρας πάγου, που συσχετίζεται με τη ζώνη κατάλυσης, μέσω υπερήχων, αξονικής ή μαγνητικής τομογραφίας. Επιπλέον, η κρυοπηξία είναι λιγότερο επώδυνη λόγω των αναισθητικών επιδράσεων της ψύξης των νεύρων και των ιστών. Κάθε κρυοκαθετήρας μπορεί να ενεργεί ανεξάρτητα από άλλους κρυοκαθετήρες, επιτρέποντας πολύ ακριβή ρύθμιση της ζώνης κατάλυσης και πιο εξατομικευμένη θεραπεία. Τέλος, κατά τη διάρκεια της κρυοπηξίας, αν και παρατηρείται θρόμβωση μικρών αγγείων, τα μεγαλύτερα αιμοφόρα αγγεία γενικά προφυλάσσονται (Hinshaw et al. 2014). Παρά τα πολυάριθμα πλεονεκτήματά της, η κρυοπηξία φέρει περιορισμούς που δεσμεύουν την εφαρμογή της στην κτηνιατρική ογκολογία. Πρώτον, το σύνδρομο λύσης του όγκου και το φαινόμενο της απορροής θερμότητας είναι πιθανές παρενέργειες που μπορεί να περιπλέξουν τη θεραπεία, καθώς και η πιθανότητα συστηματικού κρυοσοκ. (Hinshaw et al. 2014). Επιπλέον, παρόλο που η κρυοπηξία προφυλάσσει τα μεγάλα αιμοφόρα αγγεία, λόγω της έλλειψης θρόμβωσης και πήξης των μεγάλων αγγείων, οι αιμορραγικές επιπλοκές αποτελούν έναν προβληματισμό μετά την κρυοπηξία. (Erinjeri & Clark 2010). Η θεραπεία μπορεί επίσης να περιοριστεί από την αποτελεσματικότητα της ψύξης, η οποία περιορίζεται στη μικρή επιφάνεια γύρω από το κρυοκαθετήρα. (Hinshaw et al. 2014). Τέλος, ένας ιδιαίτερα αξιοσημείωτος κίνδυνος της κρυοπηξίας είναι η θραύση οργάνων, η οποία μπορεί να συμβεί σε εύθραυστους παγωμένους ιστούς σε περιπτώσεις υπερβολικής ροπής του κρυοκαθετήρα ή μετατόπισής του (Erinjeri & Clark 2010).
Η χρήση της κρυοπηξίας στην κτηνιατρική αναφέρεται κυρίως για δερματικούς και υποδόριους όγκους, με ποικίλους βαθμούς ασφάλειας και αποτελεσματικότητας. Σε μια αναδρομική μελέτη κρυοπηξίας για όγκους του δέρματος και του υποδόριου σε σκύλους, το 35% των οποίων ήταν κακοήθεις βλάβες, επιτεύχθηκε ολική κατάλυση στο 94,5% των βλαβών χωρίς υποτροπή ή μετάσταση (Ma et al. 2021).
Σε έναν σκύλο, αναφέρθηκε μακροχρόνιος έλεγχος υποτροπιάζοντος ρινικού αδενοκαρκινώματος μετά από καθοδηγούμενη με αξονική τομογραφία διαρρινική κρυοπηξία. Οι επιπλοκές που σχετίζονταν με τη θεραπεία περιλάμβαναν εστιακή λύση του τετρημενου πετάλου του ηθμοειδούς οστού, η οποία αυτοεπιλύθηκε 13 μήνες μετά τη θεραπεία, και ήπιο χρόνιο ρινικό έκκριμα. Ο σκύλος υποβλήθηκε σε ευθανασία 21 μήνες μετά τη θεραπεία λόγω οξέος αιμοπεριτοναίου και κατά τη νεκροψία διαγνώστηκε μια ηπατική μάζα σύμφωνη με σάρκωμα. (Murphy et al. 2011). Σε έναν σκύλο με ινοσάρκωμα της άνω γνάθου, επιτεύχθηκε μερική ύφεση του όγκου μετά από κρυοπηξία, διααρτηριακό εμβολισμό και συστηματική χημειοθεραπεία. (Weisse et al. 2011). Σε μια μελέτη δέκα σκύλων με ρινικό ακανθοκυτταρικό καρκίνωμα (SCC), αξιολογήθηκε ο συνδυασμός εκτομής με λέιζερ CO2 και κρυοχειρουργικής για την ανακούφιση. Μετά την αφαίρεση με λέιζερ CO2 , πραγματοποιήθηκε κρυοπηξία στον ορατό όγκο, καθώς και σε παρακείμενους και υποπαρακείμενους ιστούς μέσω τριών κύκλων ταχείας κατάψυξης/αργής απόψυξης. Η θεραπεία είχε ως αποτέλεσμα συνολικό χρόνο επιβίωσης 260 ημερών. (Ierace et al. 2018). Υποτροπή του όγκου εμφανίστηκε σε επτά από τους δέκα σκύλους που έλαβαν θεραπεία 33-136 ημέρες μετά τη θεραπεία. Οι σκύλοι με υποτροπή του όγκου υποβλήθηκαν εκ νέου σε θεραπεία με συνδυασμένη αφαίρεση με λέιζερ CO2 και κρυοπηξία αμέσως μετά την υποτροπή, με τρεις σκύλους να εμφανίζουν δεύτερη υποτροπή και έναν σκύλο να εμφανίζει πέντε υποτροπές. Αυτή η μελέτη κατέδειξε αποδεκτή παρηγορητική αντιμετώπιση του ρινικού ακανθοκυτταρικού καρκινώματος του σκύλου, με βελτιωμένη δίοδο αέρα σε όλους τους σκύλους και άριστο αισθητικό αποτέλεσμα (Ierace et al. 2018).
Κατάλυση με λέιζερ
Η κατάλυση με λέιζερ, που συχνά αναφέρεται ως διάμεση θερμοθεραπεία (laser interstitial thermal therapy) με λέιζερ (LITT), χρησιμοποιεί ηλεκτρομαγνητική ενέργεια για την πρόκληση πηκτικής νέκρωσης μέσω υπερθερμικών μηχανισμών. Κατά τη διάρκεια της κατάλυσης με LITT, τα λέιζερ παρέχουν συγκεκριμένα μήκη κύματος ηλεκτρομαγνητικής ενέργειας, συνήθως στην περιοχή του εγγύς υπέρυθρου (IR), η οποία απορροφάται από χρωμοφόρα των κυττάρων συγκριμένων ιστών. Τα κύτταρα μετατρέπουν την απορροφούμενη ενέργεια σε θερμότητα, η οποία διαχέεται στους παρακείμενους ιστούς (Hinshaw et al. 2014).
Η LITT έχει χρησιμοποιηθεί εκτενώς για την αφαίρεση όγκων στην κτηνιατρική ογκολογία για μεγάλη ποικιλία επιφανειακών και βαθύτερων όγκων, συμπεριλαμβανομένων διαφόρων καρκινωμάτων, σαρκωμάτων και αδενωμάτων, καθώς και όγκων του εγκεφάλου, του μαστικού ιστού και του προστάτη, με εξαιρετικά ποικίλα αποτελέσματα. Σε μια μελέτη με εγγύς υπερύθρου LITT σε τριάντα οκτώ σκύλους με απόφραξη λόγω καρκινώματος του μεταβατικού επιθηλίου (TCC) της κατώτερης ουροφόρου οδού, παρόλο που η διάμεση επιβίωση ήταν 380 ημέρες, υπήρχαν σημαντικοί κίνδυνοι με τη διαδικασία, με επιπλοκές όπως στραγγουρία (δύο σκύλοι), στένωση στην κυστεοουρηθρική συμβολή (τρεις σκύλοι), σπορά του TCC στην κατώτερη ουροφόρο οδό και στο σημείο της ουρηθροστομίας (δύο σκύλοι) και διάτρηση της ουρήθρας (ένας σκύλος). (Cerf & Lindquist 2012).
Σε δύο ξεχωριστές μελέτες για τη χρήση της διαενδοσκοπικής LITT για τη θεραπεία της σχετιζόμενης με το Spirocerca lupi νεοπλασίας του οισοφάγου σε σκύλους (δύο και δεκαεπτά σκύλοι), η κατάλυση με LITT συσχετίστηκε με χαμηλότερη νοσηρότητα, συγκρίσιμη μακροπρόθεσμη επιβίωση και συντομότερες νοσηλείες σε σύγκριση με τη χειρουργική αντιμετώπιση (Yas et al. 2013, Shipov et al. 2015). Μια άλλη μελέτη κατέδειξε την επιτυχή ενδοσκοπική κατάλυση LITT ενός οστεοχόνδρωματος της τραχείας σε ένα Golden Retriever ηλικίας τεσσάρων μηνών με χρήση διοδικού λέιζερ, χωρίς αξιοσημείωτες επιπλοκές μετά τη θεραπεία (Bottero et al. 2016). Σε αυτές τις μελέτες, η εκτομή LITT φάνηκε να αποτελεί ασφαλής και αποτελεσματική παρηγορητική θεραπευτική επιλογή για όγκους του οισοφάγου και της τραχείας διαφόρων ιστοπαθολογικών υποτύπων.
Η κατάλυση με LITT έχει επίσης εφαρμοστεί σε επιφανειακούς όγκους στην κτηνιατρική τόσο για την καταστροφή όσο και για την εκτομή των όγκων. Σε μια μελέτη τριάντα οκτώ σκύλων με συνολικά σαράντα δερματικούς όγκους διαφόρων τύπων, χρησιμοποιήθηκαν λέιζερ CO2 για τη σύγκριση της εκτομής, της κατάλυσης και των συνδυασμένων τεχνικών λέιζερ εκτομής και κατάλυσης. Σε δύο περιπτώσεις σημειώθηκε τοπική υποτροπή του όγκου. Ο χρόνος επούλωσης ήταν μικρότερος από δώδεκα ημέρες στο 88% των σκύλων που υποβλήθηκαν σε θεραπεία με το συνδυασμένο πρωτόκολλο εκτομής και κατάλυσης, με συνολικό χρόνο επέμβασης λιγότερο από δέκα λεπτά. (Paczuska et al. 2014). Αυτή η μελέτη κατέδειξε τα πλεονεκτήματα της θεραπείας με λέιζερ CO2 για την κατάλυση επιφανειακών όγκων και τις δυνατότητές της ως εναλλακτικής λύσης στη χειρουργική επέμβαση για τους όγκους του δέρματος, καθώς επιτρέπει την εκτομή δίχως επαφή, τις απλουστευμένες διαδικασίες και την αμελητέα βλάβη στους περιβάλλοντες ιστούς. (Paczuska et al. 2014).
Ο συνδυασμός της LITT αφαίρεσης του όγκου και διαφόρων φωτοευαισθητοποιητών έχει διερευνηθεί σε διάφορες κτηνιατρικές ογκολογικές εφαρμογές. Μια μελέτη που αξιολόγησε την κυτταροτοξική επίδραση της ενδοογκικής έγχυσης νανοράβδων χρυσού, πριν από την αφαίρεση με λέιζερ, όγκων του μαστού σε δέκα σκύλους και έξι γάτες, έδειξε πλήρη ύφεση στο 62,5% των ζώων, με 25% των ζώων να υποτροπιάζουν μετά την αρχική ανταπόκριση στη θεραπεία. Ειδικότερα, οι νανοράβδοι χρυσού δεν είχαν τοξική επίδραση στο προφίλ του αίματος ή στη λειτουργία των νεφρών ή του ήπατος και η συνολική επιβίωση ήταν 315 ημέρες (Abdoon et al. 2016). Σε μια ξεχωριστή μελέτη, τρεις ενδοογκικές δόσεις νανοράβδων χρυσού και χαμηλής δόσης LITT σε διαστήματα δύο εβδομάδων έδειξαν ότι οι όγκοι εκμηδενίστηκαν κυρίως μέσω απόπτωσης με μείωση του βαθμού κακοήθειας μετά από μία θεραπεία και πλήρη υποχώρηση μετά από τρεις. Οι μεταστάσεις απουσίαζαν στις ακτινογραφίες ένα έτος μετά τη θεραπεία (Ali et al. 2016).
Κατάλυση με μικροκύματα
Η κατάλυση με μικροκύματα (MWA) είναι μια μέθοδος θερμικής εκτομής που περιλαμβάνει τη μετάδοση ηλεκτρομαγνητικής ενέργειας μικροκυμάτων μέσω μιας κεραίας στον ιστό του όγκου. Η ενέργεια των μικροκυμάτων έχει ως αποτέλεσμα τον προσανατολισμό των μορίων του νερού εντός ενός ηλεκτρομαγνητικού πεδίου, τα οποία επαναπροσδιορίζονται συνεχώς όταν εφαρμόζεται ένα ταλαντευόμενο πεδίο μικροκυμάτων. Η συνεχής αναπροσαρμογή των μορίων νερού αυξάνει την κινητική τους ενέργεια, αυξάνοντας τη θερμοκρασία του ιστού ώστε να προκληθεί πηκτική νέκρωση του όγκου. (Hinshaw et al. 2014). Ομοίως με άλλες μεθόδους κατάλυσης, η MWA εκτελείται υπό καθο- δήγηση με υπερήχους ή με αξονική τομογραφία.
Η χρήση της MWA μπορεί να είναι ιδιαίτερα πλεονεκτική για την αφαίρεση όγκων υψηλής ηλεκτρικής αντίστασης του πνεύμονα και των οστών, επειδή η ενέργεια μικροκυμάτων διεισδύει στους βιολογικούς ιστούς ανεξάρτητα από την αντίσταση στο ηλεκτρικό ρεύμα (Andreano & Brace 2013). Επιπλέον, η MWA επιτυγχάνει γρήγορα υψηλές θερμοκρασίες με μείωση του χρόνου θεραπείας, μπορεί να δημιουργήσει σχετικά μεγάλες ζώνες κατάλυσης με παρόμοια αποτελέσματα σε διάφορους τύπους ιστών και είναι σχετικά μη ευαίσθητη στις επιδράσεις απορρόφησης θερμότητας των μεγάλων αιμοφόρων αγγείων γύρω από τον όγκο (Andreano & Brace 2013).
Είναι σημαντικό ότι υπάρχουν ορισμένοι περιορισμοί της MWA που μπορεί να μειώσουν την εφαρμογή της στην κτηνιατρική ογκολογία. Η αναγκαιότητα μηχανισμών ψύξης στις κεραίες μικροκυμάτων περιπλέκει τις διαδικασίες θεραπείας. Επιπλέον, υπάρχει μια σημαντική κλινική καμπύλη εκμάθησης λόγω των υψηλών θερμοκρασιών και της ταχείας αύξησης της θερμοκρασίας που επιτυγχάνεται κατά τη διάρκεια της θεραπείας (Andreano & Brace 2013). Τέλος, η MWA είναι μια πιο πρόσφατη προσέγγιση της θερμικής αφαίρεσης όγκων και είναι εγγενώς λιγότερο διερευνημένη από άλλες μεθόδους θερμικής αφαίρεσης και, ως εκ τούτου, τα κλινικά δεδομένα είναι ελάχιστα. Η ανάπτυξη βελτιωμένων συστημάτων MWA που αντιμετωπίζουν αυτούς τους περιορισμούς έχει οδηγήσει σε αυξημένη εφαρμογή της MWA στον άνθρωπο, η οποία μπορεί να μεταφραστεί στις κτηνιατρικές εφαρμογές. Παρά τη σχετικά πρόσφατη εισαγωγή της MWA στην κτηνιατρική, έχει διερευνηθεί σε περιορισμένο βαθμό για εφαρμογές στην κατάλυση όγκων ιστών υψηλότερης αντίστασης, όπως το ήπαρ, ο πνεύμονας, οι νεφροί και τα οστά.
Σε μια μελέτη όπου συμμετείχαν πέντε σκύλοι με μη εξαιρέσιμους πρωτοπαθείς και μεταστατικούς όγκους του ήπατος, η MWA πραγματοποιήθηκε χωρίς διεγχειρητικές επιπλοκές (Yang et al. 2017). Ωστόσο, η αξιολόγηση του οφέλους επιβίωσης και των περιόδων χωρίς νόσο δεν ήταν στο πλαίσιο αυτής της μελέτης. Σε μια μελέτη που περιελάμβανε δύο σκύλους με μεταστατικό αιμαγγειοσάρκωμα του ήπατος και πρωτοπαθές ηπατοκυτταρικό καρκίνωμα, διαπιστώθηκε η τεχνική σκοπιμότητα της λαπαροσκοπικής MWA, χωρίς διεγχειρητικές επιπλοκές (Oramas et al. 2019). Αυτή η μελέτη χρησιμοποίησε επίσης έξι πτώματα σκύλων για να επιβεβαιώσει ότι όλοι οι λοβοί του ήπατος ήταν λαπαροσκοπικά προσβάσιμοι για MWA, γεγονός που υποδηλώνει ότι η λαπαροσκοπική MWA μπορεί να είναι μια εφικτή, ελάχιστα επεμβατική θεραπευτική επιλογή για μη εξαιρέσιμες ηπατικές νεοπλασίες. Η διαδερμική MWA έχει επίσης εφαρμοστεί με επιτυχία για τη θεραπεία καρκίνου του νεφρού σε έναν σκύλο, χωρίς να παρουσιαστούν επιπλοκές και ο σκύλος εξακολουθεί να ζει 3 χρόνια μετά τη θεραπεία. (Culp et al. 2017).
Η MWA έχει επίσης διερευνηθεί για τη θεραπεία τόσο του μεταστατικού όσο και του πρωτοπαθούς (primary appendicular osteosarcoma) οστεοσαρκώματος των άκρων. Σε σκύλο μικτής φυλής ηλικίας 10 ετών με πνευμονική μετάσταση οστεοσαρκώματος των άκρων, η υποβοηθούμενη με βίντεο MWA διενεργήθηκε θωρακοσκοπικά χωρίς επιπλοκές (Mazzaccari et al. 2017). Ο σκύλος έζησε 257 ημέρες μετά την επέμβαση με βελτιωμένα κλινικά σημεία μετά τη θεραπεία, ωστόσο ο ασθενής είχε προηγουμένως υποβληθεί σε χημειοθεραπεία με δοξορουβικίνη και καρβοπλατίνη πριν από τη διάγνωση της πνευμονικής βλάβης και είναι πιθανό το παρατηρούμενο όφελος επιβίωσης μετά τη MWA να οφείλεται εν μέρει στη χημειοθεραπεία. Σε μια άλλη μελέτη δύο σκύλων με οστεοσάρκωμα των άκρων με πιθανή πνευμονική μετάσταση υπό χημειοθεραπεία, οι Dornbush et al. πραγματοποίησαν διαδερμική MWA υπό την καθοδήγηση υπερήχων και αξονικής τομογραφίας. (Dornbusch et al. 2020). Σε αυτή τη μελέτη, και οι δύο σκύλοι υπέστησαν ήπιο και μέτριο πνευμοθώρακα κατά τη διάρκεια της επέμβασης, με χρόνους επιβίωσης που ήταν συγκρίσιμοι με τους σκύλους που δεν έλαβαν θεραπεία. Ωστόσο, η επέμβαση κόστισε 50-66% όσο μια θωρακοτομή με λοβεκτομή πνεύμονα, γεγονός που υποδηλώνει ότι η MWA των πνευμονικών μεταστάσεων μπορεί να είναι σημαντικά πιο αποδοτική από τη χειρουργική επέμβαση.
Η χρήση της MWA για τη θεραπεία όγκων των οστών παρουσιάζει ιδιαίτερο ενδιαφέρον, λόγω της υψηλής ηλεκτρικής αντίστασης των οστών που περιορίζει την εφαρμογή άλλων μεθόδων θερμικής κατάλυσης. Η MWA για τη θεραπεία νεοπλασμάτων των οστών έχει διερευνηθεί περιορισμένα, με εξαιρετικά διαφορετικά κλινικά αποτελέσματα. Στην πρώτη κτηνιατρική πιλοτική μελέτη της MWA για οστικούς όγκους, έξι σκύλοι με οστεοσάρκωμα της περιφερικής κερκίδας υποβλήθηκαν σε θεραπεία με καθοδηγούμενη με ακτινοσκόπηση MWA (Salyer et al. 2020). Δεν υπήρξαν επιπλοκές κατά τη διαδικασία, αλλά δεν αναφέρθηκε μακροχρόνια παρακολούθηση των κλινικών συμπτωμάτων. Η νέκρωση του όγκου μετά τη θεραπεία κυμαινόταν μεταξύ 30 και 90%, γεγονός που σημαίνει πως απαιτούνται μεγαλύτερες και με πιο μακροχρόνια παρακολούθηση μελέτες, για την περαιτέρω αξιολόγηση της MWA για τη θεραπεία οστικών όγκων σε σκύλους.
Κατάλυση με ραδιοσυχνότητες
Η κατάλυση με ραδιοσυχνότητες (RFA) εφαρμόζει εναλλασσόμενα ηλεκτρικά ρεύματα (200-1.200 Hz) μεταξύ ηλεκτροδίων για την ενεργοποίηση του φαινομένου Joule. Στο πλαίσιο του φαινομένου Joule, η ροή του ηλεκτρικού ρεύματος προκαλεί ταχεία ταλάντωση των ιόντων στους παρακείμενους ιστούς, η οποία αυξάνει τη θερμοκρασία των ιστών κοντά στα ηλεκτρόδια μέσω τριβής (Hong & Georgiades 2010). Η προκύπτουσα ζώνη θερμικής κατάλυσης μπορεί στη συνέχεια να αυξηθεί μέσω θερμικής διάχυσης και αγωγής. Η RFA μπορεί να είναι μονοπολική, κατά την οποία το ρεύμα μεταδίδεται μέσω ενός διάμεσου ηλεκτροδίου και επιστρέφει μέσω επιφανειών γείωσης στο δέρμα, ή διπολική, κατά την οποία το ρεύμα ταλαντώνεται μεταξύ δύο διάμεσων ηλεκτροδίων ελλείψει επιφάνειας γείωσης. (Hong & Georgiades 2010).
Παρά την ελάχιστα επεμβατική φύση της RFA και την προσαρμοστικότητα της θεραπείας με τις διαμορφώσεις των ηλεκτροδίων, υπάρχουν σημαντικά μειονεκτήματα σε αυτή τη μέθοδο που περιορίζουν την εφαρμογή της στην κτηνιατρική. Κατά τη διάρκεια της θεραπείας μπορούν εύκολα να προκληθούν τραύματα στο δέρμα εάν δεν χρησιμοποιηθούν επαρκή ή σωστά τοποθετημένα μαξιλάρια γείωσης (Rhim et al. 2004). Η φύση της RFA περιορίζει επίσης την εφαρμογή της σε ορισμένους τύπους ιστών. Συγκεκριμένα, η μεταφορά θερμότητας μέσω αγωγής είναι αργή και δυσκολεύεται να ξεπεράσει την τοπική ιστική αιμάτωση ή τον αερισμό στους περισσότερους ιστούς, γεγονός που οδηγεί σε σημαντική διακύμανση των ζωνών RFA ανάλογα με την ετερογένεια του ιστού.
Εκτός από τις εφαρμογές για τη θεραπεία του υπερθυρεοειδισμού (Mallery et al. 2003) και του υπερπαραθυρεοειδισμού (Pollard et al. 2001), η πλειονότητα της χρήσης της RFA στην κτηνιατρική ογκολογία έχει γίνει σε πειραματικά μοντέλα όγκων, με περιορισμένες αναφορές περιστατικών σε ζώα πελατών. Εξ όσων γνωρίζουν οι συγγραφείς, οι μόνες περιπτώσεις χρήσης RFA για την κατάλυση όγκων σε κτηνιατρικούς ασθενείς είναι για το καρκίνωμα του προστάτη και τα καρδιακά χημειοδεκτώματα. Στην περίπτωση ενός σκύλου που διαγνώστηκε με καρκίνωμα του προστάτη, η RFA πραγματοποιήθηκε διεγχειρητικά μέσω ανοικτής επέμβασης για όγκο του προστάτη, με επιτυχή κατάλυση και χωρίς επιπλοκές (Culp et al. 2017). Στην πρώτη περιγραφή της διαδερμικής ηχοκαθοδηγούμενης RFA αορτικών όγκων, η RFA υπό υπερηχογραφική καθοδήγηση χρησιμοποιήθηκε για τη θεραπεία χημειοδεκτωμάτων σε πέντε σκύλους, χωρίς επιπλοκές κατά τη διάρκεια της επέμβασης ή τις επόμενες 24 ώρες (Gomez Ochoa et al. 2021). Οι επεμβάσεις διαρκούσαν γενικά 35 λεπτά με χρόνους ολοκλήρωσης της επίσκεψης δύο ωρών, γεγονός που υποδηλώνει ότι η ηχοκαθοδηγούμενη RFA μπορεί να είναι μια αποτελεσματικη και οικονομικά αποδοτική μέθοδος για τη θεραπεία καρδιακών όγκων σε σκύλους. Υπήρξε αξιοσημείωτη μείωση του μεγέθους του όγκου σε όλους τους σκύλους ένα μήνα μετά τη θεραπεία ενώ η ελάττωση του μεγέθους του όγκου ήταν μικρότερη τρεις μήνες μετά τη θεραπεία, γεγονός που υποδηλώνει ατελή κατάλυση. Ωστόσο, ένας σκύλος υποβλήθηκε σε θεραπεία με δεύτερη διαδερμική ηχοκαθοδηγούμενη RFA οκτώ μήνες αργότερα για την ανακούφιση της συμπίεσης της κοίλης φλέβας και ο σκύλος παρέμεινε σταθερός 6 μήνες μετά από αυτή τη διαδικασία, γεγονός που υποδηλώνει ότι η επανάληψη της ηχοκαθοδηγούμενης RFA μπορεί να είναι εφικτή για τη θεραπεία των χημειοδεκτωμάτων σκύλων. (Gomez Ochoa et al. 2021).
Κατάλυση με υπερήχους υψηλής έντασης (HIFU)
Η κατάλυση HIFU περιλαμβάνει την παροχή συγκλίνουσας δέσμης υπερήχων υψηλής ισχύος από εξωσωματικό εστιακό υπερηχογράφο προς τους στοχευμένους όγκους (Εικόνα 2). Η μηχανική δόνηση των εστιασμένων ηχητικών κυμάτων παράγει θερμότητα στον ιστό, προκαλώντας πηκτική νέκρωση του ιστού-στόχου εντός του εστιακού επιπέδου της δέσμης υπερήχων (Ter Haar 2016). Η κατάλυση HIFU πραγματοποιείται υπό καθοδήγηση με μαγνητική τομογραφία ή τη βοήθεια υπερήχων και θεωρείται η λιγότερο επεμβατική μέθοδος θερμικής εκτομής όταν χρησιμοποιείται εξωσωματικός εστιακός υπερηχογράφος για την καταστροφη επιφανειακών καλοήθων όγκων που δεν περιβάλλονται από οστά και αέρα. (Knavel & Brace 2013). Η HIFU μπορεί επίσης να εκτελεστεί με διορθικούς, διάμεσους και διαδερμικούς εστιακούς υπερηχογράφους για την εκτομή όγκων του προστάτη, όγκων της χολής και του οισοφάγου και βαθύτερων όγκων με περιορισμούς, αντίστοιχα (Ter Haar 2016).
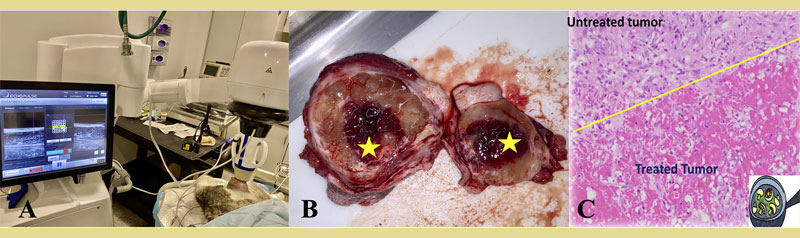
Σχήμα 2. Θεραπεία υποδόριων όγκων με εστιασμένους υπερήχους υψηλής έντασης (HIFU) σε ασθενείς σκύλους. Α) Ένας σκύλος που δι αγνώστηκε με σάρκωμα μαλακών μορίων χαμηλού βαθμού βρίσκεται υπό εισπνευστική γενική αναισθησία. Μια κλινική συσκευή HIFU καθοδηγούμενη με υπερήχους χρησιμοποιείται για τη στόχευση του όγκου που βρίσκεται στον αριστερό πλάγιο μηρό του σκύλου. Η μονάδα θεραπείας τοποθετείται πάνω από τον στοχευόμενο όγκο και η θεραπεία παρακολουθείται σε πραγματικό χρόνο μέσω υπερηχοτομογραφίας. (Β) Μακροσκοπική εικόνα ενός όγκου που έχει υποστεί θεραπεία με HIFU. Το κίτρινο αστέρι υποδεικνύει το στοχευμένο τμήμα του όγκου, το οποίο χαρακτηρίζεται από διάχυτη αιμορραγία και σκούρο κόκκινο έως μαύρο χρώμα. (C) Εικόνα μικροσκοπίου του στοχευμένου όγκου με χρώση H&E, η οποία καταδεικνύει πηκτική νέκρωση και αιμορραγία στο στοχευμένο σημείο, που διαγράφεται έντονα από τον μη στοχευμένο ιστό του όγκου (κίτρινη γραμμή). (πηγή εικόνων: προσωπικό αρχείο συγγραφέων)
Εκτός του ότι είναι η μόνη εντελώς μη επεμβατική μέθοδος θερμικής κατάλυσης, η κατάλυση με HIFU μπορεί γενικά να πραγματοποιηθεί με μεγάλη ακρίβεια μεταξύ υγιούς και μη υγιούς ιστού. Ωστόσο, η κατάλυση με HIFU είναι δυνητικά λιγότερο αποτελεσματική για βαθύτερους όγκους λόγω της χαμηλής διείσδυσης των υπερήχων μέσω των ιστών (Ter Haar 2016). Επιπλέον, υπάρχει κίνδυνος δερματικών εγκαυμάτων, βλάβης των περιφερικών νεύρων και εντερικού τραυματισμού λόγω της σκέδασης και της ανάκλασης των κυμάτων υπερήχων, ιδίως κατά τη θεραπεία σε περιοχές περιβάλλονται από οστά, που οδηγούν σε εστίαση της δέσμης εκτός στόχου. (Seward et al. 2019). Η κατάλυση με HIFU περιορίζεται περαιτέρω στη χρήση της σε περιοχές που υπόκεινται σε αναπνευστική κίνηση λόγω μειωμένης ακρίβειας ή προστατεύονται από οστά (Seward et al. 2019).
Η κατάλυση HIFU έχει ευρύ φάσμα κλινικών εφαρμογών για την εκτομή όγκων στην κτηνιατρική ογκολογία, αλλά πολλές μελέτες είναι αναδρομικής φύσης και έχουν διεξαχθεί λίγες ελεγχόμενες κλινικές δοκιμές για τη χρήση της εκτομής όγκων HIFU σε κτηνιατρικούς ασθενείς. Οι Ryu et al. αναφέρουν μια αναδρομική μελέτη έντεκα σκύλων που υποβλήθηκαν σε καταστροφή συμπαγών όγκων με HIFU, οι οποίοι περιελάμβαναν πολλαπλά καρκινώματα μεταβατικών κυττάρων της ουροδόχου κύστης, καθώς και καρκινώματα και μαστοκυττώματα του μαστικού αδένα, του οφθαλμικού κόγχου, του ισχίου και της κοιλιακής κοιλότητας (Ryu et al. 2018). Η πλειονότητα των όγκων του κορμού και της μασχάλης και όλοι οι όγκοι των άκρων ήταν στοχεύσιμοι με HIFU, ενώ οι όγκοι της κεφαλής και της σπονδυλικής στήλης ήταν οι λιγότερο στοχεύσιμοι τύποι όγκων. Τα κλινικά σημεία βελτιώθηκαν σε πέντε από τους σκύλους που υποβλήθηκαν σε θεραπεία, ενώ σταμάτησε η αιμορρα- γία σε τέσσερις σκύλους με αιμορραγικούς όγκους παρά τις ορισμένες επιπλοκές, όπως υπερθερμία, ερύθημα, εντερίτιδα και εγκαύματα στο δέρμα. Ο βέλτιστος όγκος θεραπείας για την εκτομή HIFU του STS προσδιορίστηκε ότι είναι ≤200 cm3 , με βέλτιστο και μέγιστο βάθος στόχου ≤8 cm και ≤11 cm, αντίστοιχα. Σε μια άλλη αναδρομική μελέτη σε σκύλους με σάρκωμα μαλακών μορίων, με βάση την ανάλυση της απεικόνισης, την προσβασιμότητα της περιοχής του όγκου από τη δέσμη υπερήχων και την εγγύτητα στον νωτιαίο μυελό, οι Seward και συν. αναφέρουν ότι το 81% των σκύλων που διαγνώστηκαν με σάρκωμα μαλακών μορίων είχαν όγκους που μπορούσαν να στοχευθούν με MR-καθοδηγούμενη κατάλυση με HIFU. Οι όγκοι της κεφαλής και της σπονδυλικής στήλης ήταν λιγότερο πιθανό να είναι στοχεύσιμοι, αλλά όλοι οι όγκοι των άκρων και οι περισσότεροι όγκοι του κορμού και της μασχάλης θεωρήθηκαν στοχεύσιμοι, γεγονός που υποδηλώνει δυνητικά ευρεία κλινική εφαρμογή της κατάλυσης με HIFU για τη θεραπεία του σαρκώματος μαλακών μορίων σκύλων.
Η αξιολόγηση σε κλινικές δοκιμές της κατάλυσης αυθόρμητων όγκων με HIFU σε κτηνιατρικούς ασθενείς είναι περιορισμένη, αλλά έχει αναφερθεί ένας αριθμός μικρών μελετών που αξιολογούν την κατάλυση με HIFU για διάφορους τύπους όγκων, τόσο επιφανειακούς όσο και βαθύτερους. Οι Kopelman et al. διερεύνησαν τη χρήση της MR-καθοδηγούμενης HIFU για την κατάλυση ηπατοκυτταρικού καρκινώματος σε έναν σκύλο, εφαρμόζοντας τέσσερις ξεχωριστές θεραπείες σε διάστημα οκτώ εβδομάδων. Μετά την εκτομή του όγκου μετά την τελευταία θεραπεία HIFU, η HIFU φάνηκε να στοχεύει τον όγκο με μεγάλη ακρίβεια, αλλά προκάλεσε εστιακά θερμική βλάβη στο χόνδρο των δεξιών κάτω πλευρών, προκαλώντας λοίμωξη που απαιτούσε χειρουργική επέμβαση και αναιρώντας τη μη επεμβατική φύση της εκτομής με HIFU (Kopelman et al. 2006). Παρόλο που ο ασθενής ήταν υγιής δέκα μήνες μετά τη θεραπεία, η μελέτη αυτή υπογραμμίζει τους πιθανούς κινδύνους της εφαρμογής της κατάλυσης με HIFU σε εν τω βάθει όγκους. Έχει δειχθεί ότι η κατάλυση με HIFU προκάλεσε με επιτυχία πλήρη ύφεση του όγκου σε ένα μεγάλο στοματικό νευριλείμωμα (σβάννωμα) της αριστερής άνω γνάθου ενός ασθενούς σκύλου, παρά τις ορισμένες ανεπιθύμητες παρενέργειες, συμπεριλαμβανομένων των εγκαυμάτων του στοματικού βλεννογόνου που απαιτούσαν χειρουργική και υπερβαρική θεραπεία με οξυγόνο. (Ranjan et al. 2021). Ενώ υποδηλώνει ότι η κατάλυση με HIFU μπορεί να παρακάμψει την ανάγκη για χειρουργική εκτομή του οστικού ιστού στη θεραπεία του καρκίνου του στόματος των σκύλων, η μελέτη αυτή εντόπισε επίσης αυξημένο πολλαπλασιασμό των Τ κυττάρων σε δείγματα όγκου και αίματος, υποδηλώνοντας ότι η κατάλυση με HIFU μπορεί να ενισχύσει την αντικαρκινική της δράση μέσω της εμπλοκής του ανοσοποιητικού συστήματος. Σε μια κλινική δοκιμή κατάλυσης αυθόρμητων όγκων με HIFU σε κτηνιατρικούς ασθενείς, επιφανειακοί όγκοι του λαιμού, του ποδιού, του προσώπου, της πλάτης και της κοιλιάς αντιμετωπίστηκαν με MR-καθοδηγούμενη HIFU σε έξι σκύλους και τέσσερις γάτες. (Antoniou et al. 2022). Η πηκτική νέκρωση του όγκου ήταν εμφανής στο 80% των περιπτώσεων, αλλά οι ιστολογικές εικόνες χαμηλότερης μεγέθυνσης υπέδειξαν εσφαλμένα την πλήρη καταστροφή όλων των καρκινικών κυττάρων, ενώ οι εικόνες υψηλότερης μεγέθυνσης αποκάλυψαν άθικτα καρκινικά κύτταρα. Αυτό υποδηλώνει ότι η HIFU μπορεί να είναι πιο αποτελεσματική όταν χρησιμοποιείται ως συμπλήρωμα της ακτινοθεραπείας ή της χημειοθεραπείας, προκειμένου να εξασφαλιστεί η πλήρης εξάλειψη των καρκινικών κυττάρων. Στη μεγαλύτερη μέχρι σήμερα κλινική δοκιμή θεραπείας αυθόρμητων όγκων με HIFU σε κτηνιατρικούς ασθενείς, οι Carroll et al. πραγματοποίησαν HIFU για μερική κατάλυση όγκων σε είκοσι σκύλους που είχαν διαγνωστεί με υποδόριους συμπαγείς όγκους, συμπεριλαμβανομένων δεκαπέντε σαρκωμάτων μαλακών μορίων, τριών μαστοκυττωμάτων, ενός οστεοσαρκώματος και ενός καρκινώματος του θυρεοειδούς. Η θεραπεία με HIFU ήταν καλά ανεκτή, με μόνο έναν σκύλο να εμφανίζει κλινικά σημαντικό ανεπιθύμητο συμβάν. Ένα συμβάν αποκοκκίωσης σημειώθηκε σε έναν ασθενή που διαγνώστηκε με μαστοκύττωμα, το οποίο περιορίστηκε στη θέση του όγκου και στη συνέχεια αντιμετωπίστηκε κατά τη διάρκεια της προγραμματισμένης χειρουργικής εκτομής μετά τη HIFU. Οι όγκοι αφαιρέθηκαν τρεις έως έξι ημέρες μετά τη θεραπεία με HIFU, με πλήρη καταστροφή του στοχευμένου ιστού και διήθηση ανοσοκυττάρων εμφανή στην παθολογία και την ανοσοϊστοχημεία. Επιπλέον, αυτή η μελέτη εντόπισε αύξηση της έκφρασης γονιδίων που σχετίζονται με την ενεργοποίηση των Τ-κυττάρων μετά την εκτομή με HIFU, γεγονός που υποδηλώνει ότι η HIFU μπορεί να προκαλέσει ανοσοδιεγερτικές αλλαγές για τη διαμόρφωση του μικροπεριβάλλοντος του όγκου. (Carroll et al. 2022). Η αφαίρεση ολόκληρου του όγκου δεν ήταν στόχος αυτής της μελέτης και, ως εκ τούτου, απαιτούνται πρόσθετες εργασίες για την αξιολόγηση της επιβίωσης και του κλινικού οφέλους της αφαίρεσης των υποδόριων όγκων με HIFU, τόσο ως μοναδική θεραπευτική μέθοδος όσο και ως συμπληρωματική μέθοδος στις συνήθεις θεραπείες για τη θεραπεία των υποδόριων όγκων σε σκύλους και γάτες.
Μη-θερμική κατάλυση με βάση την ενέργεια στην κτηνιατρική
Η ενεργειακή κατάλυση του όγκου μπορεί επίσης να επιτευχθεί μέσω μη θερμικών μηχανισμών. Στις μη-θερμικές μεθόδους εκτομής όγκων, η ενέργεια εξακολουθεί να εφαρμόζεται στους όγκους, αλλά αντί να προκαλούνται μεταβολές της θερμοκρασίας στον ιστό για τη θανάτωση των κυττάρων μέσω θερμικών μηχανισμών, αυτές οι μέθοδοι εφαρμόζουν ενέργεια για να χειραγωγήσουν τις κυτταρικές ιδιότητες ή να διαταράξουν μηχανικά τα κύτταρα-στόχους για τη θανάτωση των κυττάρων μέσω μη θερμικών μηχανισμών. Μη βασιζόμενη στις μεταβολές της θερμοκρασίας εντός του ιστού για τη θανάτωση των νεοπλασματικών κυττάρων, οι οποίες εξαρτώνται από τις ιδιότητες του ιστού που είναι εξαιρετικά ετερογενείς στον νεοπλασματικό ιστό, η μη-θερμική κατάλυση όγκων μπορεί να επιτύχει πιο ομοιόμορφη εκτομή και να είναι ευρύτερα εφαρμόσιμη σε διάφορους τύπους ιστών και κοντά σε κρίσιμες ανατομικές δομές. Οι μη-θερμικές μέθοδοι κατάλυσης που παρουσιάζουν ενδιαφέρον στην κτηνιατρική περιλαμβάνουν την ιστοθριψία, τη μη αναστρέψιμη ηλεκτροδιάτρηση (IRE) και τη μη αναστρέψιμη ηλεκτροδιάτρηση υψηλής συχνότητας (H-FIRE).
Ιστοθριψία
Η ιστοθριψία είναι μια πρόσφατα αναπτυγμένη μη επεμβατική, μη ιονίζουσα, μηχανική θεραπεία με βάση τη σπηλαίωση, που χρησιμοποιεί παλμι- κά εστιασμένα κύματα υπερήχων υψηλής έντασης για τη μη-θερμική καταστροφή των στοχευμένων ιστών (Bader et al. 2019, Xu et al. 2021). Η ιστοθριψία περιλαμβάνει την παροχή παλμών υπερήχων πολύ υψηλού πλάτους, μικρής διάρκειας, οι οποίοι δημιουργούν ένα πυκνό, ενεργειακό νέφος φυσαλίδων στον ιστό, με αποτέλεσμα τη μηχανική κλασματοποίηση των ιστών μετά από επαναλαμβανόμενη διαστολή και κατάρρευση των φυσαλίδων των ενδογενών αερίων του ιστού (Vlaisavljevich et al. 2016b). Αυτές οι μικροφυσαλίδες σπηλαίωσης πιστεύεται ότι σχηματίζονται στο εξωκυτταρικό υλικό, και η ταχεία διαστολή και κατάρρευσή τους παράγει υψηλή τάση και καταπόνηση στα παρακείμενα κύτταρα (Vlaisavljevich et al. 2016b), ρευστοποιώντας ουσιαστικά τον ιστό-στόχο σε ένα ομοιογενές από μη-κυτταρικά υπολείμματα που θα επαναρροφηθούν από τον οργανισμό σε διάστημα 1-2 μηνών (Vlaisavljevich et al. 2016a).
Tα κατώτατα όρια βλάβης του ιστού για την ιστοθριψία είναι ειδικά για κάθε ιστό (Vlaisavljevich et al. 2014), υποδεικνύοντας δυνατότητες βελτιστοποίησης της θεραπείας, ειδικά για την κατάλυση του νεοπλασματικού ιστού, και προστατεύοντας τους υγιείς ιστούς. Επειδή ο κυτταρικός θάνατος από την ιστοθριψία συμβαίνει με δυαδικούς μηχανισμούς, με την κυτταρική βλάβη να συμβαίνει μόνο όταν η πίεση υπερήχων υπερβαίνει το κατώφλι σπηλαίωσης, η κατάλυση με ιστοθριψία οδηγεί σε πολύ σαφή όρια μεταξύ ιστού που έχει υποστεί κατάλυση και ιστού που δεν έχει υποστεί κατάλυση με τη μεταβατική ζώνη μερικής κατάλυσης να εκτείνεται μόνο σε μερικές εκατοντάδες μικρόμετρα (Maxwell et al. 2013). Αυτός ο μη-θερμικός μηχανισμός κατάλυσης με ιστοθριψία ξεπερνά πολλούς περιορισμούς που σχετίζονται με τη θερμική κατάλυση, όπως το φαινόμενο της απαγωγής θερμότητας, η έλλειψη ακριβών ορίων και η προβλεψιμότητα της θεραπείας (Xu et al. 2019). Η σκοπιμότητα της χρήσης της ιστοθριψίας ως τεχνικής που προστατεύει τα αιμοφόρα αγγεία έχει επίσης αποδειχθεί στο ήπαρ χοίρου in vivo (Vlaisavljevich et al. 2014). Επειδή η ιστοθριψία χρησιμοποιεί εξωσωματικούς εστιακούς υπερηχογράφους, η καταστροφή του όγκου μπορεί να πραγματοποιηθεί μη επεμβατικά. Επιπλέον, η υγροποίηση του όγκου εξαλείφει την ανάγκη εκτομής του όγκου, μειώνοντας έτσι τον κίνδυνο επιπλοκών που σχετίζονται με τη χειρουργική επέμβαση, όπως η θρόμβωση (Xu et al. 2021).
Η δυνατότητα εφαρμογής της ιστοθριψίας για την εκτομή όγκων σε όργανα πλούσια σε αέρα, όπως ο πνεύμονας και ο γαστρεντερικός σωλήνας, είναι περιορισμένη λόγω των εξαιρετικά χαμηλών ορίων σπηλαίωσης σε αυτούς τους ιστούς, τα οποία θα μπορούσαν να οδηγήσουν σε σημαντικές επιπτώσεις εκτός στόχου (Xu et al. 2021). Επιπλέον, η εφαρμογή της ιστοθριψίας σε περιοχές που περικλείονται από οστά είναι περιορισμένη (Xu et al. 2021).
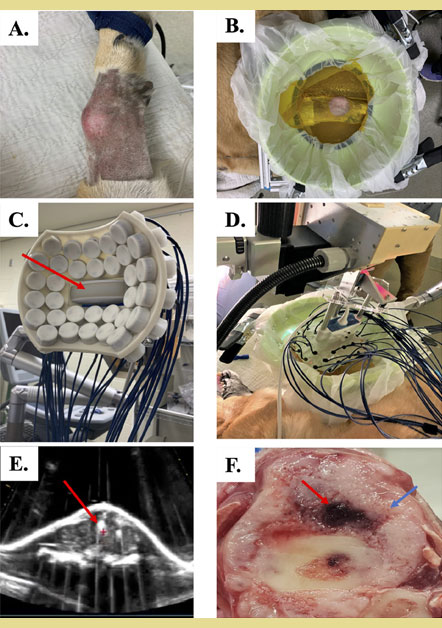
Σχήμα 3. Εγκατάσταση θεραπείας με ιστοθριψία και θεραπεία οστεοσαρκώματος σκύλου
Α) Πρωτοπαθές οστεοσάρκωμα στην άπω κερκίδα ενός ασθενούς σκύλου. Το τρίχωμα που κάλυπτε το δέρμα πάνω από τον όγκο αφαιρέθηκε για την προετοιμασία της θεραπείας με ιστοθριψία.
Β) Δοχείο σύζευξης για τη θεραπεία με ιστοθριψία γεμάτο με απαερωμένο νερό που τοποθετείται πάνω από τον όγκο.
C) Εστιακός υπερηχογράφος ιστοθριψί ας 500kHz, 32 στοιχείων με διαγνωστικό υπερηχογράφο (κόκκινο βέλος) ομοαξονικά ευθυγραμμισμένος για απεικόνιση σε πραγματικό χρόνο κατά τη διάρκεια της χορήγησης της θεραπείας.
D) Ο εστιακός υπερηχογράφος και το δοχείο σύζευξης τοποθετημένα μαζί και έτοιμα για την παροχή θε ραπείας.
E) Σύννεφο φυσαλίδων σπηλαίωσης που δημιουργείται κατά τη διάρκεια της θεραπείας ιστοθριψίας (υποδεικνύεται από το κόκκινο βέλος).
F) Μακροσκοπική εικόνα πρωτογενούς όγκου οστού που υποβλήθηκε σε θεραπεία, με το κόκκινο βέλος να υποδεικνύει τη θέση στόχευσης και το μπλε βέλος να υποδεικνύει τον μη στοχευμενο όγκο.
Λόγω της καινοτομίας της τεχνολογίας ιστοθριψίας για την κατάλυση όγκων, οι εφαρμογές της στην κτηνιατρική είναι περιορισμένες αλλά επιταχύνονται. Πιλοτικές μελέτες καταδεικνύουν την αποτελεσματικότητα της ιστοθριψίας στην εκτομή όγκων οστεοσαρκώματος σε σκύλους. (Arnold et al. 2021). Επιπλέον, στην πρώτη κλινική δοκιμή της ιστοθριψίας για μερική εκτομή οστεοσαρκώματος σε πέντε σκύλους, επιτεύχθηκε επιτυχής εκτομή εντός του όγκου-στόχου της θεραπείας, όπως προκύπτει από την παθολογία και την ιστολογία, χωρίς σημαντικές κλινικές ανεπιθύμητες ενέργειες. (Ruger et al. 2022b). Πρόσφατα, ολοκληρώθηκε μια πρώτη πιλοτική μελέτη για την αντιμετώπιση σαρκωμάτων μαλακών ιστών σε σκύλους, με την εφαρμογή της ίδιας τεχνολογίας, στην οποία αποδείχτηκαν οι αλλαγές που προκαλούνται στο μικροπεριβάλλον του όγκου, η ασφάλεια της μεθόδου και η σκοπιμότητα της χρήσης της (Ruger et al. 2022a). Αυτές οι μελέτες τεκμηρίωσαν την ασφάλεια και τη σκοπιμότητα της ιστοθριψίας για τη μη επεμβατική θεραπεία των πρωτοπαθών όγκων των οστών (Εικόνα 3) και των σαρκωμάτων των μαλακών μορίων (Εικόνα 4) σε σκύλους, αλλά απαιτούνται πρόσθετες εργασίες για την αξιολόγηση της μακροπρόθεσμης αποτελεσματικότητας και του οφέλους επιβίωσης. Επιπλέον κλινικές δοκιμές που βρίσκονται σε εξέλιξη συνεχίζουν να διερευνούν την ιστοθριψία για την κατάλυση όγκων του εγκεφάλου σε σκύλους και σαρκώματος μαλακών μορίων σε γάτες.
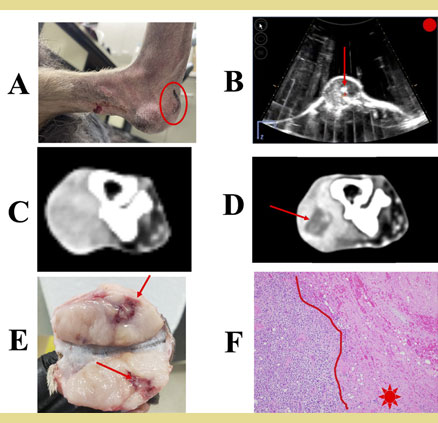
Σχήμα 4. Μηχανική, υψηλής έντασης εστιασμένη με υπερήχους κατάλυση σαρκώματος μαλακών μορίων σκύλου με ιστοθριψία.
Α) Σάρκωμα μαλα κών μορίων στην πελματιαία πτυχή του αριστερού μεταταρσίου, υποδηλώνοντας το σημείο θεραπείας (κυκλωμένο).
Β) Ζωντανή εικόνα κατά τη διάρκεια της θεραπείας με ιστοθριψία που απεικονίζει το νέφος φυσαλίδων σπηλαίωσης εντός του όγκου (βέλος).
C) Εικόνες αξονικής τομογραφίας ενισχυμένης με σκιαγραφικό πριν από τη θεραπεία και
D) 1 ημέρα μετά τη θεραπεία με ιστοθριψία που δηλώνει την έλλειψη ενίσχυσης σκιαγραφικού στη ζώνη εκτομής (βέλος).
Ε) Μακροσκοπική εικόνα που δηλώνει αιμορρα γία (βέλος) και
F) ιστοπαθολογική εικόνα που δηλώνει πλήρη απώλεια της βιωσιμότητας των κυττάρων εντός μιας ευκρινώς οριοθετημένης ζώνης εκτομής (αστέρι).
Μη αναστρέψιμη ηλεκτρoδιάτρηση (IRE) και μη αναστρέψιμη ηλεκτροδιάτρηση υψηλής συχνότητας (H-FIRE)
Κατά τη διάρκεια της μη αναστρέψιμης ηλεκτροδιάτρησης (IRE), τα κύτταρα εκτίθενται σε μονοπολικά παλμικά ηλεκτρικά πεδία που αυξάνουν το διαμεμβρανικό δυναμικό των κυττάρων-στόχων, αποσταθεροποιούν την κυτταρική μεμβράνη και προκαλούν μη-θερμικό κυτταρικό θάνατο. (Davalos et al. 2005). Τα ηλεκτρικά πεδία δημιουργούνται και παλμοδοτούνται μέσω των ιστών-στόχων μεταξύ δύο ηλεκτροδίων βελόνας που εισάγονται στους όγκους. Η δεύτερη γενιά της IRE, η μη αναστρέψιμη ηλεκτροδιάτρηση υψηλής συχνότητας (H-FIRE), παρέχει υψηλής συχνότητας, διπολικά παλμικά ηλεκτρικά πεδία για την πρόκληση οριοθετημένων περιοχών μη-θερμικής κατάλυσης. Σε σύγκριση με την IRE, η H-FIRE επιτρέπει απλούστερες κλινικές διαδικασίες, καθώς δεν απαιτεί την ανάγκη νευρομυϊκού αποκλεισμού ή καρδιακού συγχρονισμού, και μειώνει τον αριθμό των ηλεκτροδίων που απαιτούνται για τη θεραπεία. (Arena et al. 2011).
Οι μη-θερμικοί μηχανισμοί της IRE και του H-FIRE επιτρέπουν την κατάλυση κοντά σε θερμοευαίσθητες δομές και για τη διατήρηση της λειτουργίας των νεύρων και των αιμοφόρων αγγείων που επιτρέπει η προσεκτική τοποθέτηση των ηλεκτροδίων της βελόνας. Η κατάλυση των όγκων με IRE και H-FIRE είναι επίσης ελάχιστα επεμβατική και έχει δειχθεί ότι προκαλεί προσαρμοστική ανοσολογική απόκριση κατά του όγκου (Ringel-Scaia et al. 2019). Επιπλέον, η H-FIRE καταλύει κατά προτίμηση τα νεοπλασματικά κύτταρα, σε σχέση με τα υγιή κύτταρα στο περιθώριο του όγκου, επιτρέποντας την ακριβή αφαίρεση του όγκου. (Ivey et al. 2015). Ωστόσο, η εισαγωγή και η αφαίρεση ηλεκτροδίων βελόνας σε έναν όγκο ενέχει τον κίνδυνο σποράς νεοπλασματικών κυττάρων κατά μήκος των διαδρομών των ηλεκτροδίων κατά τη διάρκεια της κατάλυσης με IRE και H-FIRE.
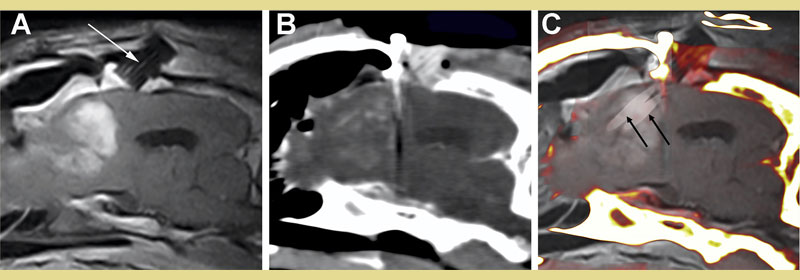
Σχήμα 5. Στερεοτακτική, απεικονιστικά καθοδηγούμενη κατάλυση γλοιώματος υψηλού βαθμού κακοήθειας σε σκύλο με μη αναστρέψιμη ηλεκτροδιάτρηση (IRE). Παραοβελιαία , μετα-σκιαγραφικού μαγνητική τομογραφία T1W (Α) και διεγχειρητική μετα-σκιαγραφικού αξονική το μογραφία (Β) που απεικονίζουν τον ενισχυόμενο όγκο στον μετωπιαίο λοβό με τον ειδικό καθετήρα και τον οδηγό αυτού (PGP) που έχει εμφυτευθεί στο υπερκείμενο μετωπιαίο οστό (βέλος, Α). Συγχώνευση εικόνων μαγνητικής τομογραφίας και διεγχειρητικής αξονικής τομογραφίας (C) που καταδεικνύει την in situ τοποθέτηση δύο ηλεκτροδίων (μαύρα βέλη) που χρησιμοποιούνται για την κατάλυση μέσω του PGP στον όγκο.
Η IRE (Εικόνα 5) και η H-FIRE (Εικόνα 6) έχουν χρησιμοποιηθεί σε συγκεκριμένες μικρές μελέτες περιστατικών για την αντιμετώπιση όγκων σε σκύλους. Η IRE έχει χρησιμοποιηθεί για την κατάλυση σαρκώματος μαλακών μορίων σε έναν σκύλο (Neal et al. 2011), και για την κατάλυση γλοιώματος σκύλου ως μοναδική μέθοδος θεραπείας (Rossmeisl et al. 2015) και με επικουρική ακτινοθεραπεία (Garcia et al. 2011). Όταν η IRE χρησιμοποιήθηκε για την εκτομή ενός περιαρθρικού ιστιοκυτταρικού σαρκώματος του οπίσθιου άκρου, τα κλινικά συμπτώματα χωλότητας βελτιώθηκαν, αλλά σημειώθηκε υποτροπή του όγκου. Ο σκύλος έλαβε χημειοθεραπευτική αγωγή με CCNU και υποβλήθηκε εκ νέου σε θεραπεία με IRE για την αντιμετώπιση εστιακής υποτροπής τέσσερις μήνες μετά τη θεραπεία, πιθανώς λόγω αντοχής στην CCNU, και επιτεύχθηκε ολική ύφεση του όγκου. (Neal et al. 2011). Ο σκύλος επέζησε για επιπλέον 5 χρόνια μετά τη θεραπεία και υποβλήθηκε σε ευθανασία λόγω άσχετων αιτιών. Αυτή η μελέτη καθιέρωσε τη δυνητική εφαρμογή της IRE για τη θεραπεία πρωτοπαθών νεοπλασιών, καθώς και για τη θεραπεία όγκων ανθεκτικών σε άλλες θεραπευτικές αγωγές. Οι Garcia et al. χρησιμοποίησαν αργότερα την IRE με επικουρική κλασματοποιημένη ακτινοθεραπεία για την πολυτροπική θεραπεία γλοιώματος σκύλου σε έναν ασθενή, με αποτέλεσμα τη μείωση του μεγέθους του όγκου κατά 75% 48 ώρες μετά την IRE και τη σημαντική βελτίωση των κλινικών συμπτωμάτων τις εβδομάδες μετά την IRE καθ’ όλη τη δι- άρκεια της ακτινοθεραπείας (Garcia et al. 2011). Η πλήρης ύφεση τεκμηριώθηκε τέσσερις μήνες μετά την ΙRE, παρά τα στοιχεία της πρώιμης-καθυστερημένης ακτινονέκρωσης, που τελικά κατέστησε αναγκαία την ευθανασία 149 ημέρες μετά την ΙRE, χωρίς ενδείξεις υποτροπής του όγκου κατά τη νεκροψία. Συνολικά, είναι πιθανό ότι η θεραπεία IRE ακτινοευαισθητοποίησε το γλοίωμα σε αυτόν τον ασθενή, γεγονός που δικαιολογεί περαιτέρω διερεύνηση. Σε μια μεταγενέστερη μελέτη επτά σκύλων με γλοίωμα που υποβλήθηκαν σε θεραπεία μόνο με IRE, εμφανίστηκε σοβαρή τοξικότητα μετά τη θεραπεία, συμπεριλαμβανομένης θανατηφόρας πνευμονίας από εισρόφηση και εγκεφαλικού οιδήματος που σχετιζόταν με τη θεραπεία, σε δύο σκύλους. Ωστόσο, τα κλινικά συμπτώματα βελτιώθηκαν ομοιόμορφα, με χρόνους επιβίωσης έως και 940 ημέρες μετά την ΙRΕ με διάμεσο χρόνο επιβίωσης 119 ημέρες. (Rossmeisl et al. 2015).
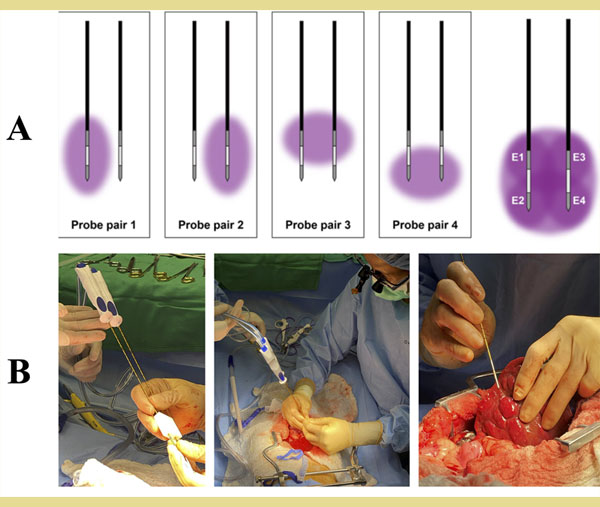
Σχήμα 6. Χρήση μη αναστρέψιμης ηλεκτροδιάτρησης υψηλής συχνότητας (H-FIRE) για την κατάλυση όγκων μαλακών μορίων σε σκύλους. Α) Συνδυασμοί παλμικών ακολουθιών ανάμεσα σε δύο διπολικά ηλεκτρό - δια H-FIRE μπορούν να επιτύχουν μια χωρικά μεγαλύτερη, συγκλίνουσα ζώνη κατάλυσης ιστού. Β) Παράλληλα, διπολικά ηελεκτρόδια H-FIRE που συγκρατούνται με προκαθορισμένη απόσταση μεταξύ τους μέσω τρισ διάστατα εκτυπωμένου οδηγού (αριστερά) εισάγονται σε πρωτοπαθή όγκο του ήπατος, χρησιμοποιώντας χειρουργική διαδικασία ανοικτής προσέγγισης (μέση). Εισαγωγή ενός μόνο διπολικού ηλεκτροδίου για στοχευμένη κατάλυση πολλαπλών όζων στην επιφάνεια του ήπατος (δεξιά).
Οι διαδικαστικοί περιορισμοί και οι επιπλοκές που σχετίζονται με τη θεραπεία της κατάλυσης όγκων με IRE στην κτηνιατρική οδήγησαν στην ανάπτυξη της H-FIRE, η οποία έχει διερευνηθεί για την κατάλυση του μηνιγγιώματος και του ηπατοκυτταρικού καρκινώματος σκύλων. Σε μια μελέτη της κατάλυσης με H-FIRE αυθόρμητου μηνιγγιώματος σε τρεις σκύλους, οι Latouche και συν. πραγματοποίησαν H-FIRE χωρίς διεγχειρητική ή μετεγχειρητική επιπλοκή σε δύο από τους τρεις σκύλους, και με αιμορραγία και υπόταση που σχετίζονταν με την χειρουργική εκτομή σε έναν σκύλο. (Latouche et al. 2018). Ομοιόμορφες νεκρωτικές καταλυσεις επιτεύχθηκαν σε δύο από τους τρεις σκύλους, αλλά μη ομοιόμορφη θεραπεία εμφανίστηκε σε έναν σκύλο, πιθανώς λόγω ανοργανοποίησης του εσωτερικού του όγκου. Ένας σκύλος παρέμεινε ελεύθερος όγκου έξι μήνες μετά τη θεραπεία, ενώ υπήρχε υποψία υποτροπής του όγκου σε έναν άλλο σκύλο πέντε μήνες μετά την H-FIRE. (Latouche et al. 2018). Αυτή η μελέτη καθιέρωσε την ασφάλεια και την κλινική σκοπιμότητα της ενδοκρανιακής διαδικασίας H-FIRE, αλλά λόγω της θεραπευτικής φύσης αυτής της μελέτης, απαιτούνται πρόσθετες εργασίες προκειμένου να αξιολογηθεί η μακροπρόθεσμη αποτελεσματικότητα του H-FIRE στην πρόκληση ύφεσης του όγκου σε σκύλους που έχουν διαγνωστεί με μηνιγγίωμα. Σε μια μεταγενέστερη μελέτη του H-FIRE για την κατάλυση ηπατοκυτταρικού καρκινώματος σε τρεις σκύλους, οι Partridge και συν. κατέδειξαν καλά καθορισμένη διαδερμική κατάλυση σε δύο από τους τρεις ασθενείς, με ήπια μυϊκή συστολή και χωρίς καρδιακή αρρυθμία, και χωρίς κλινικά σημαντικές ανεπιθύμητες ενέργειες που σχετίζονται με τη θεραπεία. (Partridge et al. 2020). Παρατηρήθηκε διήθηση CD3+ λεμφοκυττάρων στις αντιδραστικές ζώνες που περιβάλλουν τους στοχευμένους όγκους που υποβλήθηκαν σε θεραπεία, γεγονός που υποδηλώνει την επαγωγή μιας προφλεγμονώδους ανοσολογικής απόκρισης μετά την κατάλυση H-FIRE του ηπατοκυτταρικού καρκινώματος. Δύο από τους τρεις σκύλους εξακολουθούσαν να ζουν περισσότερο από δώδεκα μήνες μετά τη θεραπεία με H-FIRE, χωρίς ενδείξεις υποτροπής ή μετάστασης του όγκου. (Partridge et al. 2020). Απαιτούνται πρόσθετες μελέτες προκειμένου να εκτιμηθεί το όφελος επιβίωσης και τα μακροπρόθεσμα αντικαρκινικά αποτελέσματα της H-FIRE στην αντιμετώπιση του αυθόρμητου ηπατοκυτταρικού καρκινώματος σκύλων χωρίς χειρουργικη εκτομή του όγκου, αλλά η παρούσα μελέτη καθιέρωσε την ασφάλεια και τη σκοπιμότητα της διαδικασίας με πολλά υποσχόμενα κλινικά αποτελέσματα. Οι έρευνες για τη χρήση του H-FIRE για τη θεραπεία πρωτοπαθών όγκων του πνεύμονα σε σκύλους βρίσκονται σε εξέλιξη.
Συμπεράσματα
Η ενεργειακή κατάλυση όγκων χρήζει περαιτέρω διερεύνησης στην κτηνιατρική, καθώς υπόσχεται ιδιαίτερα να προσφέρει τόσο θεραπευτική όσο και παρηγορητική θεραπεία σε ζώα συντροφιάς με καρκίνο. Η κατάλυση με βάση την ενέργεια έχει τη δυνατότητα να προσφέρει εξωνοσοκομειακή, ελάχιστα ή μη επεμβατική, και προσαρμόσιμη αντινεοπλασματική θεραπεία, περιορίζοντας παράλληλα τη νοσηρότητα που σχετίζεται με τις συνήθεις μεθόδους θεραπείας ακριβείας. Η ευρεία χρήση θεραπευτικών μεθόδων κατάλυσης όγκων με βάση την ενέργεια στην κτηνιατρική βρίσκεται σε πρώιμο στάδιο, κυρίως λόγω της απαιτούμενης τεχνικής εμπειρογνωμοσύνης και του κόστους των νέων συστημάτων. Με περαιτέρω διερεύνηση, τόσο οι θερμικές όσο και οι μη θερμικές μέθοδοι κατάλυσης όγκων με βάση την ενέργεια μπορούν να βελτιστοποιηθούν και να εφαρμοστούν ως μοναδικές θεραπευτικές αγωγές ή ως βοηθητικά μέσα στις συνήθεις θεραπευτικές μεθόδους για τη θεραπεία διαφόρων τύπων όγκων στην κτηνιατρική ογκολογία.
Σύγκρουση συμφερόντων
Οι Drs Dervisis, Rossmeisl, και Davalos έχουν καθιερώσει πατέντα ή/και εκκρεμούν πατέντες ευρεσιτεχνίας στον τομέα της μη αναστρέψιμης ηλεκτροδιάτρησης. Οι Drs Dervisis και Davalos υπηρετούν ως επιστημονικοί σύμβουλοι στην ManaMedTech LLC. Ο Dr. Vlaisavljevich έχει οικονομικό συμφέρον και συνεχιζόμενη ερευνητική συνεργασία με την HistoSonics Inc.
Ευχαριστίες
Θα θέλαμε να ευχαριστήσουμε θερμά όλους τους αφοσιωμένους πελάτες/γονείς κατοικίδιων ζώων και τους κτηνιάτρους πρωτοβάθμιας φροντίδας τους για την ενεργό προσπάθεια να εγγράψουν τα ζώα τους στις διάφορες κλινικές δοκιμές που συνοψίζονται σε αυτό το χειρόγραφο. Χωρίς αυτούς, δεν μπορεί να υπάρξει καμία πρόοδος στον τομέα της κτηνιατρικής αντικαρκινικής ιατρικής.
Βιβλιογραφία
- Abdoon AS, Al-Ashkar EA, Kandil OM, Shaban AM, Khaled HM, El Sayed MA, El Shaer MM, Shaalan AH, Eisa WH, Eldin AA, Hussein HA, El Ashkar MR, Ali MR, Shabaka AA (2016) Efficacy and toxicity of plasmonic photothermal therapy (PPTT) using gold nanorods (GNRs) against mammary tumors in dogs and cats. Nanomedicine 12, 2291-2297.
- Ali MR, Ibrahim IM, Ali HR, Selim SA, El-Sayed MA (2016) Treatment of natural mammary gland tumors in canines and felines using gold nanorods-assisted plasmonic photothermal therapy to induce tumor apoptosis. Int J Nanomedicine 11, 4849-4863.
- Andreano A, Brace CL (2013) A comparison of direct heating during radiofrequency and microwave ablation in ex vivo liver.Cardiovasc Intervent Radiol 36, 505-11.
- Antoniou A, Evripidou N, Panayiotou S, Spanoudes K, Damianou C (2022) Treatment of canine and feline sarcoma using MR-guided focused ultrasound system. J Ultrasound.
- Arena CB, Sano MB, Rossmeisl JH Jr., Caldwell JL, Garcia PA, Rylander MN, Davalos RV (2011) High-frequency irreversible electroporation (H-FIRE) for non-thermal ablation without muscle contraction. Biomed Eng Online 10, 102.
- Arnold L, Hendricks-Wenger A, Coutermarsh-Ott S, Gannon J, Hay AN, Dervisis N, Klahn S, Allen IC, Tuohy J, Vlaisavljevich E (2021) Histotripsy Ablation of Bone Tumors: Feasibility Study in Excised Canine Osteosarcoma Tumors. Ultrasound Med Biol 47, 3435-3446.
- Bader KB, Vlaisavljevich E, Maxwell AD (2019) For Whom the Bubble Grows: Physical Principles of Bubble Nucleation and Dynamics in Histotripsy Ultrasound Therapy. Ultrasound Med Biol 45, 1056-1080.
- Bottero E, Cagnasso A, Gianella P (2016) Diode laser ablation of a tracheal osteochondroma in a dog. J Small Anim Pract 57, 382-5.
- Carroll J, Coutermarsh-Ott S, Klahn SL, Tuohy J, Barry SL, Allen IC, Hay AN, Ruth J, Dervisis N (2022) High intensity focused ultrasound for the treatment of solid tumors: a pilot study in canine cancer patients. Int J Hyperthermia 39, 855-864.
- Cerf DJ, Lindquist EC (2012) Palliative ultrasound-guided endoscopic diode laser ablation of transitional cell carcinomas of the lower urinary tract in dogs. J Am Vet Med Assoc 240, 51-60.
- Culp W, Johnson E, Palm C. Use of thermal ablation techniques in the treatment of canine urogenital neoplasia. In: Proceedings of Veterinary Interventional Radiology and Interventional Endoscopy Society Meeting 2017, Cabo San Lucas, Mexico, p. 6.
- Davalos RV, Mir IL, Rubinsky B (2005) Tissue ablation with irreversible electroporation.Ann Biomed Eng 33, 223-31.
- Dornbusch JA, Wavreille VA, Dent B, Fuerst JA, Green EM, Selmic LE (2020) Percutaneous microwave ablation of solitary presumptive pulmonary metastases in two dogs with appendicular osteosarcoma. Vet Surg 49, 1174-1182.
- Erinjeri JP, Clark TW (2010) Cryoablation: mechanism of action and devices. J Vasc Interv Radiol 21, 187-91.
- Garcia PA, Pancotto T, Rossmeisl JH, Jr., Henao-Guerrero N, Gustafson NR, Daniel GB, Robertson JL, Ellis TL, Davalos RV (2011) Non-thermal irreversible electroporation (N-TIRE) and adjuvant fractionated radiotherapeutic multimodal therapy for intracranial malignant glioma in a canine patient. Technol Cancer Res Treat 10, 73-83.
- Gomez Ochoa P, Alferez MD, de Blas I, Fernendes T, Sanchez Salguero X, Balana B, Melendez Lazo A, Barbero Fernandez A, Caivano D, Corda F, Corda A (2021) Ultrasound-Guided Radiofrequency Ablation of Chemodectomas in Five Dogs. Animals (Basel) 11.
- Hinshaw JL, Lubner MG, Ziemlewicz TJ, Lee FT, Jr., Brace CL (2014) Percutaneous tumor ablation tools: microwave, radiofrequency, or cryoablation-what should you use and why? Radiographics 34, 1344-62.
- Hong K, Georgiades C (2010) Radiofrequency ablation: mechanism of action and devices. J Vasc Interv Radiol 21, S179-86.
- Ierace MK, Canfield MS, Peters-Kennedy J, Kane CW (2018) Combined carbon dioxide laser and cryosurgical ablation of rostral nasal septum squamous cell carcinoma in 10 dogs. Vet Dermatol 29, 431-e142.
- Ivey JW, Latouche EL, Sano MB, Rossmeisl JH, Davalos RV, Verbridge SS (2015) Targeted cellular ablation based on the morphology of malignant cells. Sci Rep 5, 17157.
- Knavel EM, Brace CL (2013) Tumor ablation: common modalities and general practices. Tech Vasc Interv Radiol 16, 192-200.
- Kopelman D, Inbar Y, Hanannel A, Dank G, Freundlich D, Perel A, Castel D, Greenfeld A, Salomon T, Sareli M, Valeanu A, Papa M (2006) Magnetic resonance-guided focused ultrasound surgery (MRgFUS). Four ablation treatments of a single canine hepatocellular adenoma. HPB (Oxford) 8, 292-8.
- Latouche EL, Arena CB, Ivey JW, Garcia PA, Pancotto TE, Pavlisko N, Verbridge SS, Davalos RV, Rossmeisl JH (2018). High-Frequency Irreversible Electroporation for Intracranial Meningioma: A Feasibility Study in a Spontaneous Canine Tumor Model. Technol Cancer Res Treat 17, 1533033818785285.
- Ma J, Yu X, Lv J, Lin D, Lin J, Bai Y, Wang Y, Li X, Dong J (2021) Cryotherapy mediates histopathological and microstructural changes during the treatment of skin and subcutaneous tumors in dogs. Cryobiology 98, 164-171.
- Mallery KF, Pollard RE, Nelson RW, Hornof WJ, Feldman EC (2003) Percutaneous ultrasound-guided radiofrequency heat ablation for treatment of hyperthyroidism in cats. J Am Vet Med Assoc 223, 1602-7.
- Maxwell AD, Cain CA, Hall TL, Fowlkes JB, Xu Z (2013) Probability of cavitation for single ultrasound pulses applied to tissues and tissue-mimicking materials. Ultrasound Med Biol 39, 449-65.
- Mazzaccari K, Boston SE, Toskich BB, Bowles K, Case JB (2017) Video-assisted microwave ablation for the treatment of a metastatic lung lesion in a dog with appendicular osteosarcoma and hypertrophic osteopathy. Vet Surg 46, 1161-1165.
- Murphy SM, Lawrence JA, Schmiedt CW, Davis KW, Lee FT, Jr., Forrest LJ, Bjorling DE (2011) Image-guided transnasal cryoablation of a recurrent nasal adenocarcinoma in a dog. J Small Anim Pract 52, 329-33.
- Neal RE, 2nd, Rossmeisl JH, Jr., Garcia PA, Lanz OI, Henao-Guerrero N, Davalos RV (2011) Successful treatment of a large soft tissue sarcoma with irreversible electroporation. J Clin Oncol 29, e372-7.
- Oramas A, Case JB, Toskich BB, Fox-Alvarez WA, Boston SE, Giglio RF, Dark MJ (2019) Laparoscopic access to the liver and application of laparoscopic microwave ablation in 2 dogs with liver neoplasia. Vet Surg 48, 91-98.
- Paczuska J, Kielbowicz Z, Nowak M, Antonczyk A, Ciaputa R, Nicpon J (2014) The carbon dioxide laser: an alternative surgery technique for the treatment of common cutaneous tumors in dogs. Acta Vet Scand 56, 1.
- Partridge BR, O’Brien TJ, Lorenzo MF, Coutermarsh-Ott SL, Barry SL, Stadler K, Muro N, Meyerhoeffer M, Allen IC, Davalos RV, Dervisis NG (2020) High-Frequency Irreversible Electroporation for Treatment of Primary Liver Cancer: A Proof-of-Principle Study in Canine Hepatocellular Carcinoma. J Vasc Interv Radiol 31, 482-491 e4.
- Pollard RE, Long CD, Nelson RW, Hornof WJ, Feldman EC (2001) Percutaneous ultrasonographically guided radiofrequency heat ablation for treatment of primary hyperparathyroidism in dogs. J Am Vet Med Assoc 218, 1106-10.
- Ranjan A, Kishore D, Ashar H, Neel T, Singh A, More S (2021) Focused ultrasound ablation of a large canine oral tumor achieves efficient tumor remission: a case report. Int J Hyperthermia 38, 552-560.
- Rhim H, Dodd GD, 3rd, Chintapalli KN, Wood BJ, Dupuy DE, Hvizda JL, Sewell PE, Goldberg SN (2004) Radiofrequency thermal ablation of abdominal tumors: lessons learned from complications. Radiographics 24, 41-52.
- Ringel-Scaia VM, Beitel-White N, Lorenzo MF, Brock RM, Huie KE, Coutermarsh-Ott S, Eden K, McDaniel DK, Verbridge SS, Rossmeisl JH, Jr., Oestreich KJ, Davalos RV, Allen IC (2019) High-frequency irreversible electroporation is an effective tumor ablation strategy that induces immunologic cell death and promotes systemic anti-tumor immunity. EBioMedicine 44, 112-125.
- Rossmeisl JH, Jr., Garcia PA, Pancotto TE, Robertson JL, Henao-Guerrero N, Neal RE, 2nd, Ellis TL, Davalos RV (2015) Safety and feasibility of the NanoKnife system for irreversible electroporation ablative treatment of canine spontaneous intracranial gliomas. J Neurosurg 123, 1008-25.
- Ruger L, Yang E, Gannon J, Sheppard H, Coutermarsh-Ott S, Ziemlewicz TJ, Dervisis N, Allen IC, Daniel GB, Tuohy J, Vlaisavljevich E, Klahn S (2022a) Mechanical High-Intensity Focused Ultrasound (Histotripsy) in Dogs with Spontaneously Occurring Soft Tissue Sarcomas. IEEE Trans Biomed Eng PP.
- Ruger LN, Hay AN, Gannon JM, Sheppard HO, Coutermarsh-Ott SL, Daniel GB, Kierski KR, Ciepluch BJ, Vlaisavljevich E, Tuohy JL (2022b) Histotripsy Ablation of Spontaneously Occurring Canine Bone Tumors In Vivo. IEEE Trans Biomed Eng PP.
- Ryu MO, Lee SH, Ahn JO, Song WJ, Li Q, Youn HY (2018) Treatment of solid tumors in dogs using veterinary high-intensity focused ultrasound: A retrospective clinical study. Vet J 234, 126-129.
- Salyer SA, Wavreille VA, Fenger JM, Jennings RN, Selmic LE (2020). Evaluation of microwave ablation for local treatment of dogs with distal radial osteosarcoma: A pilot study. Vet Surg 49, 1396-1405.
- Seward MC, Daniel GB, Ruth JD, Dervisis N, Partanen A, Yarmolenko PS (2019) Feasibility of targeting canine soft tissue sarcoma with MR-guided high-intensity focused ultrasound. Int J Hyperthermia 35, 205-215.
- Shipov A, Kelmer G, Lavy E, Milgram J, Aroch I, Segev G (2015) Long-term outcome of transendoscopic oesophageal mass ablation in dogs with Spirocerca lupi-associated oesophageal sarcoma. Vet Rec 177, 365.
- Ter Haar G (2016) HIFU Tissue Ablation: Concept and Devices. Adv Exp Med Biol 880, 3-20.
- Vascellari M, Baioni E, Ru G, Carminato A, Mutinelli F (2009) Animal tumour registry of two provinces in northern Italy: incidence of spontaneous tumours in dogs and cats. BMC Vet Res 5, 39.
- Vlaisavljevich E, Greve J, Cheng X, Ives K, Shi J, Jin L, Arvidson A, Hall T, Welling TH, Owens G, Roberts W, Xu Z (2016a) Non-Invasive Ultrasound Liver Ablation Using Histotripsy: Chronic Study in an In Vivo Rodent Model. Ultrasound Med Biol 42, 1890-902.
- Vlaisavljevich E, Kim Y, Owens G, Roberts W, Cain C, Xu Z (2014) Effects of tissue mechanical properties on susceptibility to histotripsy-induced tissue damage. Phys Med Biol 59, 253-70.
- Vlaisavljevich E, Maxwell A, Mancia L, Johnsen E, Cain C, Xu Z (2016b) Visualizing the Histotripsy Process: Bubble Cloud-Cancer Cell Interactions in a Tissue-Mimicking Environment. Ultrasound Med Biol 42, 2466-77.
- Weisse C, Berent A, Solomon S. Combined transarterial embolization, systemic cyclophosphamide, and cryotherapy ablation for “Hi-Lo” maxillary fibrosarcoma in a dog. In: Proceedings of the 8th Annual Meeting, Veterinary Endoscopy Society 2011, San Pedro, Belize.
- Xu W, Zhang X, Hu X, Zhiyi C, Huang P (2019) Translational Prospects of ultrasound-mediated tumor immunotherapy: Preclinical advances and safety considerations. Cancer Lett 460, 86-95.
- Xu Z, Hall TL, Vlaisavljevich E, Lee FT, Jr. (2021) Histotripsy: the first noninvasive, non-ionizing, non-thermal ablation technique based on ultrasound. Int J Hyperthermia 38, 561-575.
- Yang T, Case JB, Boston S, Dark MJ, Toskich B (2017) Microwave ablation for treatment of hepatic neoplasia in five dogs. J Am Vet Med Assoc 250, 79-85.
- Yas E, Kelmer G, Shipov A, Ben-Oz J, Segev G (2013) Successful transendoscopic oesophageal mass ablation in two dogs with Spirocerca lupi associated oesophageal sarcoma. J Small Anim Pract 54, 495-8.
Υπεύθυνη αλληλογραφίας:
Kelsey Murphy
e-mail: Αυτή η διεύθυνση ηλεκτρονικού ταχυδρομείου προστατεύεται από τους αυτοματισμούς αποστολέων ανεπιθύμητων μηνυμάτων. Χρειάζεται να ενεργοποιήσετε τη JavaScript για να μπορέσετε να τη δείτε.




