Παναγιώτα Καραμιχάλη κτηνίατρος, MSc, Κυριακή Γιαμουστάρη κτηνίατρος, Αναστασία Κομνηνού κτηνίατρος, PhD
Κλινική Ζώων Συντροφιάς, Τμήμα Κτηνιατρικής, Α.Π.Θ., Θεσσαλονίκη
MeSH keywords:
analgesia, fluid therapy, intraoperative monitoring, rabbits, Rodentia
Περίληψη
Το άρθρο περιγράφει τους κατάλληλους χειρισμούς που πρέπει να γίνονται στο πλαίσιο της προ-αναισθητικής κλινικής εξέτασης, τους δυνατούς τρόπους για θεραπεία με υγρά, τον έλεγχο των ζωτικών λειτουργιών κατά τη διάρκεια της χειρουργικής επέμβασης και τέλος την εκτίμηση και τη διαχείριση του περιεγχειρητικού πόνου στον κόνικλο και τα κατοικίδια τρωκτικά.
Εισαγωγή
Η δημοτικότητα του κονίκλου και των κατοικίδιων τρωκτικών (μυς, επίμυς, ινδικό χοιρίδιο, οι γερβίλος, κρικητός/χάμστερ) αυξάνεται, καθώς και ο αριθμός των χειρουργικών επεμβάσεων στις οποίες υποβάλλονται. Σε αυτό συμβάλλει και ο μεγάλος όγκος πληροφοριών που προέρχεται κυρίως από τη χρήση τους ως ζώων εργαστηρίου. Παρόλα αυτά, τα ποσοστά περιεγχειρητικής θνησιμότητάς τους (1,39%) είναι 6-9 φορές μεγαλύτερα από τα αντίστοιχα ποσοστάσε σκύλους (0,17%) και γάτες (0,24%) (Brodbelt 2009). Η περιεγχειρητική φροντίδα συνεπώς αυτών των ζώων αποτελεί πρόκληση για τον κτηνίατρο. Αυτή η εργασία έχει ως στόχο να παρουσιάσει τρόπους επίτευξης βέλτιστου αποτελέσματος, μέγιστης ασφάλειας και ελάχιστου στρες σε αυτά τα ζωικά είδη στην καθημερινή κλινική πράξη. Σε αυτό το πλαίσιο αναλύονται οι απαραίτητοι χειρισμοί κατά την προαναισθητική κλινική εξέταση, η θεραπεία με υγρά, ο έλεγχος των ζωτικών λειτουργιών και η διαχείριση πόνου μετεγχειρητικά.
Κλινική εξέταση
Ο κόνικλος και τα κατοικίδια τρωκτικά είναι ευάλωτα στο στρες: το κλουβί μεταφοράς, η θερμοκρασία περιβάλλοντος, οι χειρισμοί από τον εξεταστή, οι δυνατοί θόρυβοι, ο φωτισμός, ο πόνος κ.ά. μπορεί να προκαλέσουν αύξηση των επιπέδων κορτιζόλης, κατεχολαμινών και θυροξίνης, και μείωση των επιπέδων ινσουλίνης. Το περιεγχειρητικό στρες επηρεάζει σε μεγάλο βαθμό τη μετεγχειρητική κατάσταση του ζώου, δηλαδή τη στάση/κίνηση του ζώου, την κατανάλωση τροφής, την αυτοπεριποίηση και γενικά την κλινική εικόνα του (Canon et al. 2011, Gaskil & Garner, 2017).
Οι χειρισμοί του κτηνιάτρου κατά την κλινική εξέταση πρέπει να είναι συγκεκριμένοι, σταθεροί και να γίνονται σε ήσυχο περιβάλλον και απομονωμένο από τα άλλα ζώα του κτηνιατρείου. Ειδικότερα για κάθε είδος, προτείνεται:
Κόνικλος
Ο κόνικλος είναι συνήθως ευάγωγος. Στην περίπτωση που εξετάζεται ένα επιθετικό ζώο, οι κύριοι κίνδυνοι προέρχονται από τα νύχια του που μπορούν να προκαλέσουν βαθιές αμυχές, και τους τομείς, οι οποίοι μπορούν να προκαλέσουν βαθιά τραύματα. Η συγκράτηση πρέπει να γίνεται με ήπιο και σταθερό τρόπο. Μεγάλη προσοχή πρέπει να δοθεί κατά τη συγκράτηση των οπισθίων άκρων, καθώς με μία δυνατή και απότομη ώθηση είναι πιθανό να προκληθεί κάταγμα στη σπονδυλική στήλη. Ακόμη, μερικές φορές το έντονο στρες κατά την εξέταση μπορεί να προκαλέσει καρδιακή ανακοπή. Συνεπώς είναι απαραίτητο να υπάρχει σύντομη και ασφαλής συγκράτηση από τον εξεταστή (Flecknell 2006).
Η συγκράτηση μπορεί να γίνει με το ένα χέρι του εξεταστή στον τράχηλο του ζώου και το άλλο χέρι να συγκρατεί τα οπίσθια άκρα φέρνοντας τα σε κατακόρυφη θέση. Εναλλακτικά, το ένα χέρι μπορεί να τοποθετηθεί κάτω από το θώρακα, με τον αντίχειρα και τα πρώτα δύο δάχτυλα να περικλείουν τα πρόσθια άκρα, ενώ το άλλο τοποθετείται κάτω από τα οπίσθια άκρα έτσι ώστε να υποστηρίζεται η ράχη (Εικόνα 1Α). Ο κόνικλος όταν μεταφέρεται πρέπει να συγκρατείται κοντά στο σώμα του εξεταστή, έτσι ώστε το σώμα του ζώου να στηρίζεται στο ένα αντιβράχιο του εξεταστή και με το άλλο χέρι να συγκρατείται η ράχη και ο τράχηλος του ζώου (Εικόνα 1Β). Μια ακόμα τεχνική συγκράτησης είναι αυτή σε ύπτια θέση, ώστε η ράχη να ακουμπά στο εξεταστικό τραπέζι και το ένα χέρι του εξεταστή να συγκρατεί το στήθος του ζώου. Αυτή είναι μια συμπεριφορά-στάση ακινητοποίησης που εκδηλώνουν και τα ίδια τα ζώα στη φύση όταν θέλουν να παραστήσουν στον θηρευτή τους ότι είναι νεκρά. Η στάση αυτή όμως στρεσάρει πολύ το ζώο, επομένως επώδυνοι χειρισμοί κατά τη συγκράτηση αυτή πρέπει να αποφεύγονται. Σε καμία περίπτωση ο κόνικλος δεν πρέπει να συγκρατείται ή να σηκώνονται από τα αυτιά (Meredith & Crossley 2002).
Σημαντική μείωση του στρες μπορεί να επιτευχθεί εάν καλυφθούν τα μάτια του ζώου με το χέρι ή τυλιχτεί το κεφάλι του με μια πετσέτα (Εικόνα 1Γ). Με τον τρόπο αυτό μπορεί να γίνει και η κλινική εξέταση της στοματικής κοιλότητας και των ώτων. Πρέπει να δίνεται ιδιαίτερη προσοχή κατά τη συγκράτηση μέσα σε πετσέτα, καθώς υπάρχει κίνδυνος υπερθερμίας. Συνεπώς η θερμοκρασία του περιβάλλοντος δεν πρέπει να ξεπερνά τους 23-25ºC (Flecknell 2006).
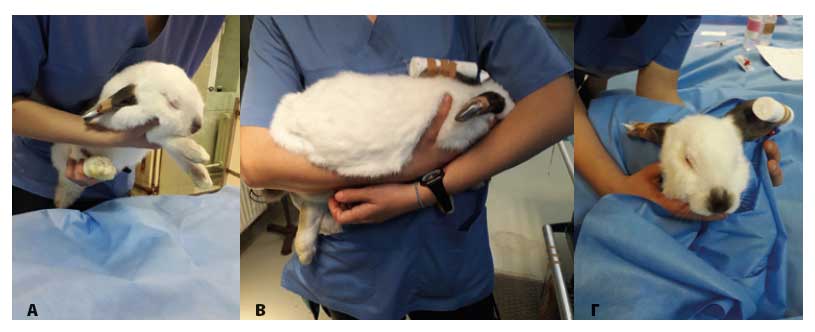
Εικόνα 1. Συγκράτηση του κονίκλου κατά την κλινική εξέταση. Α: Το ένα χέρι του εξεταστή τοποθετείται κάτω από το θώρακα, με τον αντίχειρα και τα πρώτα δύο δάχτυλα να περικλείουν τα πρόσθια άκρα, ενώ το άλλο τοποθετείται κάτω από τα οπίσθια άκρα έτσι ώστε να υποστηρίζεται η ράχη. Β: Το σώμα του ζώου στηρίζεται στο αντιβράχιο του εξεταστή με το κεφάλι ανάμεσα από το σώμα του εξεταστή και το αντιβράχιο. Γ: Το σώμα του ζώου τυλίγεται με μία πετσέτα για τη μείωση του στρες (αρχείο του συγγραφέα ΠΚ).
Μυς
Οι χειρισμοί στον μυ πρέπει να είναι οι ελάχιστοι δυνατοί, καθώς αυτό το ζώο συχνά δαγκώνει έναν άγνωστο χειριστή, ειδικά σε μη οικείο περιβάλλον. Η ακινητοποίηση γίνεται πιάνοντας τον μυν από τη βάση της ουράς και μεταφέρο- ντάς το σε μια μη ολισθηρή επιφάνεια, όπου ενστικτωδώς θα μετακινηθεί προς την αντίθετη κατεύθυνση. Στη συνέχεια, με το ένα χέρι συγκρατείται η ουρά και με το άλλο χέρι συλλαμβάνεται το δέρμα της άνω επιφάνειας του τραχήλου με το δείκτη και τον αντίχειρα. Χρήσιμη είναι η σύλληψη ικανής επιφάνειας δέρματος, με τρόπο ώστε να μη μπορεί να στρίψει το κεφάλι του για να δαγκώσει, αλλά και να μη δυσχεραίνεται η αναπνοή του ζώου. Ο εξεταστής μπορεί τότε να το σηκώσει συγκρατώντας την ουρά (Orr 2002).
Η θερμορύθμιση σε αυτό το ζωικό είδος, όπως και στους επίμυς, γίνεται μέσω των αγγείων της ουράς (Owens et al. 2002). Σε περίπτωση πτώσης της θερμοκρασίας του σώματος, γίνεται αγγειοσύσπαση των αγγείων της ουράς και μπορεί να διατηρηθεί με αυτόν τον τρόπο έως και το 17% της συνολικής θερμότητας του σώματος (Monson and Oyama 1984). Επομένως, είναι αναγκαία η συνεχής θέρμανση των ζώων αυτών με τεχνητά μέσα (κουβέρτες, λάμπες θέρμανσης) και η ιδανική θερμοκρασία περιβάλλοντος στο χώρο του χειρουργείου πρέπει να είναι 26-28ºC (Orr 2002).
Επίμυς
Οι επίμυες σε αντίθεση με τους μυς δαγκώνουν σπάνια, ειδικά αν έχουν εξοικειωθεί με την ανθρώπινη επαφή από νεαρή ηλικία. Οι επίμυες, όπως και οι μύες, είναι νυκτόβια ζώα, οπότε και σε αυτήν την περίπτωση πρέπει να εξασφαλίζεται ότι είναι σε εγρήγορση κατά την κλινική εξέταση (Tranquilli et al. 2013). Η συγκράτηση γίνεται με τον αντίχειρα και τα υπόλοιπα δάκτυλα του ενός χεριού να περικλείουν τη θωρακική κοιλότητα του ζώου στο ύψος των ώμων, ενώ το άλλο χέρι τοποθετείται κάτω από τα πίσω άκρα, υποστηρίζοντας έτσι το βάρος του ζώου. Σε επώδυνες διαδικασίες ο αντίχειρας του εξεταστή τοποθετείται κάτω από τη γνάθο του ζώου, ώστε να μη δαγκώσει. Σε περίπτωση που το ζώο είναι επιθετικό, μπορεί να ανασηκωθεί πιάνοντάς το από τη βάση της ουράς. Η μεταφορά και η συγκράτηση των επίμυων από το δέρμα του τραχήλου, σε αντίθεση με τον μυ, είναι έντονα στρεσογόνος και πρέπει να αποφεύγεται (Orr 2002).
Κρικητός
Η διαχείριση του κρικητού μπορεί να είναι δύσκολη, όμως αν η συγκράτηση γίνει σωστά, μπορεί να αποφευχθεί ο τραυματισμός. Όταν το ζώο είναι σχετικά εξοικειωμένο με τον άνθρωπο μπορεί να μεταφερθεί και να περιορισθεί μέσα στις παλάμες των χεριών. Σε πιο επιθετικά ζώα, αφού μεταφερθούν σε μη ολισθηρό δάπεδο, η συγκράτησή τους γίνεται με ήπιες αλλά αποφασιστικές κινήσεις, με τον αντίχειρα και τα δάχτυλα του ενός χεριού, να συλλαμβάνουν το δέρμα πάνω από τον τράχηλο. Στη συνέχεια μετακινείται το δέρμα στο σημείο αυτό προς το κεφάλι του ζώου για να βεβαιωθεί ότι έχει συλληφθεί ικανή ποσότητα. Έτσι αποφεύγεται ο τραυματισμός του εξεταστή και παράλληλα δεν πιέζεται το δέρμα γύρω από το λαιμό του ζώου. Σε περίπτωση έντονης και κακής συγκράτησης του δέρματος γύρω από το λαιμό πολύ συχνά παρατηρείται πρόπτωση του βολβού του οφθαλμού. Όταν το ζώο είναι πολύ επιθετικό, η χρήση ενός μικρού δοχείου από γυαλί ή η χρήση σχαρωτού κλωβού με κάλυμμα μπορεί να αποβεί χρήσιμη για την εξέταση και τη μεταφορά. Ιδανική θερμοκρασία περιβάλλοντος σε αυτά τα ζώα είναι 20-25ºC (Harkness and Wagner 1995, Goodman 2002).
Γερβίλος
Στον γερβίλο, σε περιπτώσεις κακού χειρισμού είναι συχνά τα κατάγματα των άκρων. Έτσι πρέπει πάντα αυτό το ζώο να εξετάζεται πάνω σε ένα τραπέζι ή μια επίπεδη επιφάνεια, ώστε σε περίπτωση που αναπηδήσει από το φόβο τους και πέσει να μη τραυματιστεί. Δεν είναι επιθετικό ζώο, δαγκώνει σπάνια, ενώ η συγκράτηση από την ουρά απαγορεύεται, καθώς είναι εύκολο να αποκολληθεί το δέρμα και να εκτεθεί το υποκείμενο οστό. Η απλή μεταφορά του μπορεί να γίνει εύκολα μέσα στις παλάμες των δύο χεριών (όπως και στον κρικητό). Η πλήρης ακινητοποίηση γίνεται είτε συλλαμβάνοντας το δέρμα πάνω από τον τράχηλο με τον αντίχειρα και τα δάχτυλα του ενός χεριού και στηρίζοντας το σώμα του ζώου με το άλλο χέρι, είτε στηρίζοντας το σώμα στα δύο χέρια και τους αντίχειρες κάτω από τη γνάθο του ζώου. Η ιδανική θερμοκρασία περιβάλλοντος είναι 20-25ºC (Cruz and Junquera 1993, Wurbel 2001, Kebble E 2002).
Ινδικό χοιρίδιο
Το ινδικό χοιρίδιο είναι ευάγωγο ζώο με ήρεμη ιδιοσυγκρασία, όμως στρεσάρεται πολύ όταν βρίσκεται σε μη οικείο περιβάλλον. Η αποφυγή της έκθεσής του σε έντονο φως και ήχους βοηθάει πολύ την εξέταση και τη διαχείρισή του. Δεν δαγκώνει, ωστόσο μπορεί να τρέξει πολύ γρήγορα για να αποφύγει την ακινητοποίηση. Η συγκράτησή του γίνεται πιάνοντάς το γρήγορα και σταθερά γύρω από τους ώμους με το ένα χέρι και υποστηρίζοντας το βάρος του ζώου κάτω από τα πίσω άκρα με το άλλο χέρι. Έχει μεγάλη κοιλιακή κοιλότητα, αλλά λεπτά οστά και εύθραυστη σπονδυλική στήλη. Επομένως, σε όλη τη διάρκεια της εξέτασης είναι σημαντικό να στηρίζεται το βάρος του ζώου στο χέρι του εξεταστή για να αποφευχθεί οποιοσδήποτε τραυματισμός. Ιδιαίτερη προσοχή κατά τη συγκράτηση πρέπει να δίνεται, ώστε να μην πιεστεί έντονα η κοιλιακή κοιλότητα διότι υπάρχει κίνδυνος ρήξης του ήπατος. Η ιδανική θερμοκρασία περιβάλλοντος είναι 18-23ºC (Flecknell 2002, Wagner 2014).
Τσιντσιλά
Το τσιντσιλά είναι ζώο εύκολα στη διαχείριση και δαγκώνει σπάνια. Για την κλινική εξέταση απαιτείται ήσυχο περιβάλλον καθώς στρεσάρεται εύκολα. Κινείται πολύ γρήγορα, είναι ικανός άλτης και για αυτό είναι καλύτερα η ακινητοποίησή του να γίνεται απευθείας μέσα στο κλουβί του και να μεταφέρεται μετά στο εξεταστικό τραπέζι. Η προσέγγισή του πρέπει να γίνεται ήρεμη, περικλείοντας το θώρακα με το ένα χέρι και υποβαστάζοντας με το άλλο το σώμα του. Εναλλακτικά, μπορεί να συλληφθεί από τη βάση της ουράς και το σώμα να υποστηρίζεται όπως και περιγράφεται παραπάνω. Παρόλο που το τρίχωμά του είναι πυκνό, δεν είναι καλά προσκολλημένο στο δέρμα και αποκολλάται εύκολα, χαρακτηριστικό που χρησιμοποιεί ως αμυντικό μηχανισμό στη φύση. Επομένως η συγκράτησή του από το δέρμα του τραχήλου πρέπει να αποφεύγεται, επειδή είναι πολύ εύκολο να χάσουν το τρίχωμα σε εκείνο το σημείο. Ακόμη, μερικά τσιντσιλά, όταν στρεσάρονται, κρατούν πίσω τα οπίσθια άκρα τους και μπορεί να ουρήσουν το χειριστή με εκπληκτική ακρίβεια. Τέλος, δεν έχουν ιδρωτοποιούς αδένες και είναι επιρρεπή σε θερμοπληξία όταν η θερμοκρασία του περιβάλλοντος υπερβαίνει τους 28ºC (Alworth 2012).
Καθετηριασμός περιφερικής φλέβας και χορήγηση υγρών
Στον Πίνακα 1 παρουσιάζεται ο ρυθμός χορήγησης και η δόση των συχνότερα χορηγούμενων υγρών στον κόνικλο και τα κατοικίδια τρωκτικά.

IV: ενδοφλεβίως, IO: ενδοστικώς, IP: ενδοπεριτοναϊκώς, SC: υποδορίως
Σε κάθε χειρουργική επέμβαση πλην ορισμένων μικροεπεμβάσεων συνιστάται η χορήγηση θερμών ισότονων υγρών, ιδανικά μέσω ενδοφλέβιου καθετήρα. Στον κόνικλο για τη χορήγηση υγρών προτιμάται η επιπολής ωτιαία και η κεφαλική φλέβα (καθετήρας μεγέθους 22G σε ζώα συνήθως μεγαλύτερα των 3 kg και 24-26G σε μικρότερα ζώα) (Lichtenberger 2007). Εναλλακτικές οδοί χορήγησης αποτελούν η υποδόρια και η ενδοπεριτοναϊκή, αλλά όχι για υγρά που περιέχουν γλυκόζη. Ο καθετηριασμός των περιφερικών φλεβών διευκολύνεται με επάλειψη του δέρματος με κρέμα τοπικού αναισθητικού (π.χ. λιδοκαΐνη-πριλοκαΐνη, EMLA cream™). Αποτελεσματική τοπική αναισθησία εξασφαλίζεται με επάλειψη του δέρματος της περιοχής πάνω από τη φλέβα που θα καθετηριαστεί 15 λεπτά έως και μία ώρα πριν, και κάλυψή της με μια πλαστική μεμβράνη και αυτοκόλλητο επίδεσμο (Flecknell 1990, Erkert & MacAllister 2005, Keating et al. 2012). Ανάλογο αναισθητικό αποτέλεσμα έχει βρεθεί με εφαρμογή 1 ml EMLA cream™, ύστερα από κούρεμα του δέρματος, χωρίς επίδεση και αναμονή 10 λεπτά προτού καθετηριαστεί η φλέβα (Kazakos et al. 2010). Παρότι δεν υπάρχουν αναφορές τοξίκωσης (π.χ. μεθαιμοσφαιριναιμία) στα μικρά θηλαστικά μετά τη χρήση EMLA cream™, καλό είναι να τηρούνται οι κανόνες ορθής εφαρμογής της (ποσότητα, έκταση επιφάνειας εφαρμογής κ.λπ.).
Στον επίμυ χρησιμοποιείται η επιπολής πλάγια κοκκυγική φλέβα. Στα νεαρά ζώα ή σε ζώα με καρδιαγγειακή κατάρρευση είναι χρήσιμη η ενδοστική χορήγηση, στην οποία η βελόνη μπορεί να μείνει για 72 ώρες χωρίς έκπλυση (αν η παροχή υγρών δεν είναι συνεχής, πραγματοποιείται έκπλυση δύο φορές ημερησίως). Το μηριαίο και η κνήμη, ως μακρά οστά, χρησιμοποιούνται συχνότερα στην κλινική πράξη για ενδοστική χορήγηση υγρών (Lennox 2008, Edis 2016). Ο ενδοστικός καθετηριασμός χρησιμοποιείται κυρίως για βραχυχρόνια χορήγηση υγρών, μέχρι την τοποθέτηση ενδοφλέβιου καθετήρα. Ο ενδοστικός καθετήρας μπορεί να ενοχλεί το άκρο του ζώου, ενώ μπορεί να προκαλέσει οστεομυελίτιδα, λόγω μη άσηπτων συνθηκών τοποθέτησης ή μακροχρόνιας παραμονής. Σε σηπτικούς ασθενείς και σε ασθενείς με μεταβολική νόσο των οστών η χρήση του αντενδείκνυται (Quesenberry & Carpenter 2012).
Λόγω του μικρού μεγέθους αυτών των ζώων είναι σημαντικός ο ορθός υπολογισμός της συνολικής ποσότητας των χορηγούμενων υγρών που θα λάβουν, με στόχο να αποφευχθούν επιπλοκές από υπερβολική χορήγηση. Ενδεικτικά, η υποδόρια και η ενδομυϊκή χορήγηση μεγάλης ποσότητας υγρών έχει περιγραφεί ότι μπορεί να προκαλέσει πόνο, τοπικό ερεθισμό έως και νέκρωση των μυών και αυτό-ακρωτηριασμό του άκρου (Smiler et al. 1990). Ως επιπλοκές από λανθασμένη υπερβολική χορήγηση ενδοφλέβιων υγρών έχουν αναφερθεί σοκ, αναπνευστική δυσχέρεια, αιμοδυναμική αστάθεια, ακόμα και θάνατος (Morton et al. 1997, Morton et al. 2001).
Έλεγχος των ζωτικών λειτουργιών (monitoring)
Ο έλεγχος των ζωτικών λειτουργιών (monitoring) του ζώου είναι απαραίτητο να αρχίζει από την προαναισθητική κλινική εξέταση, έως και την πλήρη ανάνηψη από τη γενική αναισθησία. Οι περισσότερες χειρουργικές επεμβάσεις μπορούν να πραγματοποιηθούν όταν το αντανακλαστικό της κάμψης απουσιάζει ή είναι μόλις αντιληπτό (Bannon & Malberg 2007, Deuis 2017). Στο ινδικό χοιρίδιό μπορεί να χρησιμοποιηθεί εναλλακτικά το αντανακλαστικό του πτερυγίου του ωτός. Τα οφθαλμικά αντανακλαστικά δεν χρησιμοποιούνται επειδή συνήθως διατηρούνται σε κάποιο βαθμό διεγχειρητικά. Η απουσία τους δηλώνει πολύ βαθιά αναισθησία (Quesenberry & Carpenter 2012).
Το μικρό μέγεθος των κονίκλων και των κατοικίδιων τρωκτικών μπορεί να προκαλέσει προβλήματα στη λειτουργία κάποιων συσκευών ελέγχου των ζωτικών λειτουργιών. Η μικρή διαφορά ηλεκτρικού δυναμικού που αναπτύσσεται στο μυοκάρδιο είναι δύσκολα ανιχνεύσιμη από μερικές συσκευές. Επιπλέον, αυτά τα ζωικά είδη έχουν υψηλή καρδιακή συχνότητα, η οποία μπορεί να ξεπεράσει το ανώτατο όριο ανίχνευσης των παλμικών οξυμέτρων. Οι μικροί όγκοι αναπνοής και ο ασθενής σφυγμός περιορίζουν τη χρήση καπνογράφων και πιεσομέτρων, αντίστοιχα. Στον κόνικλο και τα μεγάλα τρωκτικά, ενδέχεται να λειτουργήσουν καλά μετρητές αναπνοής με θερμίστορ, αλλά συχνά αποτυγχάνουν να ανιχνεύσουν την εκπνοή σε μικρότερα ζώα.
Παρά τα προβλήματα, υπάρχει δυνατότητα να γίνει έλεγχος των ζωτικών λειτουργιών. Στη διεθνή αγορά κυκλοφορεί ειδικός εξοπλισμός (π.χ. καπνογράφοι) για μικρά θηλαστικά. Επίσης, διατίθενται παλμικά οξύμετρα με δυνατότητα ανίχνευσης υψηλών καρδιακών συχνοτήτων (ταχύτητα σάρωσης 100-200 mm sec-1 αντί της συνήθους 25 mm sec-1) και οι αισθητήρες μπορούν να τοποθετηθούν στα πέλματα ή το στόμα των μεγαλύτερων ειδών (πάνω από 200 g). Οι βελόνες στα ηλεκτρόδια των ηλεκτροκαρδιογράφων είναι ιδανικές για μικρά τρωκτικά, καθώς παρέχουν άριστη αγωγιμότητα χωρίς τη χρήση γέλης. Εναλλακτικά, μπορούν να χρησιμοποιηθούν μεταλλικά μανταλάκια συνδεδεμένα σε υποδερμική βελόνα ή με βαμβάκι βρεγμένο με αλατούχο διάλυμα (Flecknell 2006). Η μέτρηση της αρτηριακής πίεσης στον κόνικλο, όταν το επιτρέπει το μέγεθός του, μπορεί να γίνει είτε άμεσα (μετά από εισαγωγή αρτηριακού καθετήρα στη μέση ωτιαία αρτηρία), είτε έμμεσα με την ταλαντωσιμετρική ή την τεχνική Doppler. Έρευνες έχουν αποδείξει ότι η καταγραφή της πίεσης μέσω μη επεμβατικών μεθόδων είναι αξιόπιστη και σε φυσιολογικούς και σε υποτασικούς κονίκλους (Ypsilantis et al. 2005, Harvey et al. 2012, Bellini et al. 2018).
Η αναπνευστική συχνότητα κατά τη διάρκεια της αναισθησίας είναι 30-60 min-1 στον κόνικλο και 50-100 min-1 στα τρωκτικά. Μείωση της αναπνευστικής συχνότητας κατά πάνω από 50% πρέπει να αντιμετωπίζεται ως επείγουσα κατάσταση (Flecknell 2006, Quesenberry & Carpenter 2012). Σημειώνεται ότι η εμφάνιση κυάνωσης στη γλώσσα του κονίκλου με τη χρήση λαρυγγικής μάσκας μπορεί να είναι αποτέλεσμα πίεσης από τη μάσκα, λόγω του μικρού μεγέθους της στοματικής κοιλότητας και να μην υποδηλώνει συστηματική διαταραχή (Kazakos et al. 2007).
Για την εκτίμηση της θερμοκρασίας είναι σημαντικό να χρησιμοποιείται θερμόμετρο που μετρά θερμοκρασία μικρότερη από 35ºC, καθώς η πτώση της μπορεί να είναι σημαντική σε αυτά τα ζώα (Flecknell 2006). Η ιδανική περιεγχειρητική και διεγχειρητική χορήγηση υγρών γίνεται ενδοφλέβια ή ενδοστικά. Εάν καμία από τις δύο επιλογές δεν είναι εφικτή, τα υγρά χορηγούνται υποδόρια ή ενδοπεριτοναϊκά (η απορρόφηση είναι σημαντικά βραδύτερη σε αυτές τις περιπτώσεις).
Αναλγησία
Εκτίμηση του πόνου
Η εκτίμηση του μετεγχειρητικού πόνου στον κόνικλο και τα κατοικίδια τρωκτικά είναι δυσκολότερη από ότι στο σκύλο και τη γάτα. Παρότι τα σημεία του πόνου είναι διακριτά, ο κλινικός κτηνίατρος συνήθως δεν είναι εξοικειωμένος με τη φυσιολογική συμπεριφορά αυτών των ζωικών ειδών. Αυτά τα ζώα, ως θηράματα, τείνουν να αποκρύπτουν μια επώδυνη κατάστασή τους και να διατηρούν φυσιολογική συμπεριφορά, προκειμένου να αποφύγουν τη σύλληψη. Η ανθρώπινη παρουσία μπορεί να τους προκαλέσει πλήρη ακινησία, χωρίς εμφανείς εκδηλώσεις πόνου. Οι συνήθεις κλινικές εκδηλώσεις που σχετίζονται με πόνο περιλαμβάνουν τη μειωμένη πρόσληψη τροφής, τη μεταβολή της κινητικής και κοινωνικής δραστηριότητας, τις μεταβολές στη στάση και τη βάδιση και τη λείξη ή μάσηση της επώδυνης περιοχής του σώματος. Η ανορεξία είναι μια κρίσιμη ένδειξη πόνου και μπορεί να ακολουθεί τη μειωμένη γαστρεντερική κινητικότητα (Wenger 2012).
Στον κόνικλο και τον μυ (και σε κάποια άλλα ζώα εργαστηρίου) έχει περιγραφεί μια βαθμονομημένη κλίμακα μέτρησης του μετεγχειρητικού πόνου, γνωστή ως “rabbit grimace scale” και “mouse grimace scale” αντίστοιχα (Langford et al. 2010, Keating et al. 2012). Η κλίμακα αυτή στηρίζεται σε εκφράσεις του προσώπου, όπως η διάμετρος των οφθαλμικών κογχών, η χαλάρωση των ζυγωματικών, το σχήμα του ακρορρινίου, το τριχωτό της κεφαλής και το σχήμα και η θέση των πτερυγίων των ώτων. Αναλόγως του αθροίσματος της βαθμολόγησης αποφασίζεται αν θα χορηγηθεί σωστική αναλγησία στο ζώο (Hampshire & Robertson 2015). Οι περιορισμοί που παρουσιάζει η κλίμακα αυτή, είναι ότι αφορά συγκεκριμένες φυλές και είδη ζώων, συγκεκριμένες χειρουργικές επεμβάσεις και δεν έχει εφαρμοστεί ευρέως εκτός εργαστηρίου (Miller & Leach 2015).
Διαχείριση του πόνου
Η αναγνώριση του πόνου όσο το δυνατόν νωρίτερα είναι ζωτικής σημασίας για την επαρκή αντιμετώπισή του πριν την εμφάνιση δυσμενών επιπτώσεων (Kohn et al. 2007). Στον κόνικλο, ανορεξία που υπερβαίνει τις 1-2 ημέρες μπορεί ταχύτατα να οδηγήσει σε δυνητικά απειλητική για τη ζωή τους γαστρεντερική στάση (Wenger 2012). Ο πόνος συμβάλλει στην ανοσοκαταστολή και ο επακόλουθος κίνδυνος λοίμωξης πρέπει να λαμβάνεται υπόψη σε αυτά τα ζώα, συμπεριλαμβανομένου του κονίκλου, στον οποίο είναι συχνές οι υποκλινικές αναπνευστικές νόσοι. Ένας αποτελεσματικός τρόπος διαχείρισης του πόνου είναι η πολυμορφική αναλγησία (Wenger 2012). Ένα αποτελεσματικό πολυδύναμο πλάνο αναλγησίας περιλαμβάνει συνήθως συνδυασμούς διαφόρων κατηγοριών αναλγητικών φαρμάκων, όπως οπιοειδών, μη στεροειδών αντιφλεγμονωδών (εφόσον δεν αντενδείκνυνται), τοπικών αναισθητικών, α-2 αγωνιστών, κεταμίνης, γκαμπαπεντίνης, κ.ά. (Benato et al. 2019). Επίσης βρίσκει εφαρμογή και μη φαρμακολογική υποστήριξη με βελονισμό, ψυχρά επιθέματα, ελάχιστα επεμβατική χειρουργική επέμβαση, προσεκτικούς χειρισμούς, λέιζερ χαμηλής στάθμης, κ.ά. (Berry 2015). Στον Πίνακα 2 παρουσιάζονται οι δόσεις των αναλγητικών φαρμάκων που χρησιμοποιούνται συχνότερα στον κόνικλο και τα κατοικίδια τρωκτικά.
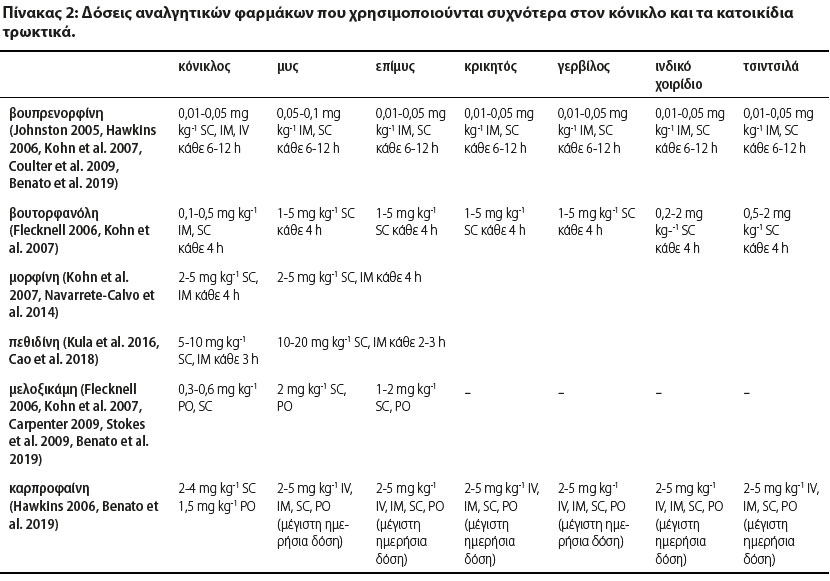
IV: ενδοφλεβίως, IM: ενδομυϊκώς, SC: υποδορίως, PO: από το στόμα
Οπιοειδή
Οι επιβλαβείς επιπτώσεις του πόνου στην κινητικότητα του γαστρεντερικού συστήματος ελέγχονται με κατάλληλη χορήγηση οπιοειδών στον κόνικλο και τα κατοικίδια τρωκτικά, ιδίως σε αυτά που αντενδείκνυνται τα μη στεροειδή αντιφλεγμονώδη φάρμακα (Swisher et al. 2015). Η χρήση της φαιντανύλης σε υψηλές δόσεις προϋποθέτει ετοιμότητα διασωλήνωσης και παροχής θετικού αερισμού, ιδιαίτερα όταν συνδυάζεται με ηρεμιστικά (Barter 2011). Η φαιντανύλη χρησιμοποιείται σε συνδυασμό με κάποιο ηρεμιστικό που καταστέλλει μερικές από τις ανεπιθύμητες παρενέργειες αυτής, όπως έμετο και διέγερση. Όταν χρησιμοποιείται μόνη της, η ελάχιστη μυϊκή χάλαση που προκαλεί την καθιστά ακατάλληλη για οποιαδήποτε άλλη, πέρα από μια βραχεία χειρουργική επέμβαση. Η δόση της φαιντανύλης μπορεί να ελαττωθεί κατά 50-70%, όταν αυτή χορηγηθεί με μια βενζοδιαζεπίνη και με το συνδυασμό αυτό παρέχεται ικανοποιητική μυοχάλαση. Η μορφίνη όταν χορηγείται στον κόνικλο έχει καλά αποτελέσματα για την αντιμετώπιση ήπιου έως ισχυρού πόνου, αλλά λόγω των παρενεργειών της, όπως ηρέμηση, αναπνευστική καταστολή και ελαττωμένη γαστρεντερική κινητικότητα, χρησιμοποιείται σπάνια (Barter 2011). Στον μυ και τον επίμυ, η βουτορφανόλη χρησιμοποιείται για την αντιμετώπιση ήπιου και μικρής διάρκειας πόνου και χορηγείται κάθε 1-2 ώρες (Gades et al. 2000), ενώ στον κόνικλο συνιστάται για ήπιο έως μέτριας έντασης και μικρής διάρκειας (2-3 ωρών) πόνο (Barter 2011). Η χρήση της τραμαδόλης, παρόλο που αυτή κυκλοφορεί στην ελληνική αγορά, σε αυτά τα ζώα αντενδείκνυται. Ειδικά στον κόνικλο, η χορήγησή της είτε από το στόμα είτε ενδοφλεβίως δεν έδειξε θετικά αναλγητικά αποτελέσματα (Souza et al. 2008, Egger et al. 2009).
Μη στεροειδή αντιφλεγμονώδη φάρμακα (ΜΣΑΦ)
Τα συχνότερα χρησιμοποιούμενα ΜΣΑΦ στον κόνικλο και τα κατοικίδια τρωκτικά είναι η μελοξικάμη, η καρπροφαίνη και η κετοπροφαίνη (Barter 2011). Στην κλινική πράξη χρησιμοποιείται συχνότερα η μελοξικάμη (Bourque et al. 2010; Wenger 2012). Στον κόνικλο μετά τη χορήγηση μελοξικάμης από το στόμα, η μέγιστη συγκέντρωση στο πλάσμα εμφανίζεται νωρίτερα και ο μεταβολισμός είναι ταχύτερος από ότι στο σκύλο, τον επίμυ και τον άνθρωπο (Turner et al. 2006). Στον κόνικλο ενδέχεται να χρειαστούν δόσεις πάνω από 0,3 mg kg-1 24h-1 για τη διατήρηση της μέγιστης συγκέντρωσής της στο πλάσμα, και για μέχρι 24 ώρες. Η δόση 1,5 mg kg-1 SC ή PO είναι καλά ανεκτή μέχρι και για 5 ημέρες (Carpenter et al. 2009, Fredholm et al. 2013). Η γεύση μελιού της πόσιμης μελοξικάμης καθιστά το φάρμακο εύγευστο για τα ζώα και είναι κατάλληλο για διαχείριση του πόνου στο σπίτι (Leach et al. 2009, Wegner 2012). Ωστόσο, οι από του στόματος δόσεις μελοξικάμης μπορεί να μην αρκούν για τον ικανοποιητικό έλεγχο του πόνου μετά από ενδοκοιλιακή επέμβαση (π.χ. ωοθηκυστερεκτομή). Παρότι δόσεις μελοξικάμης 0,2 mg kg-1 έχουν αντιφλεγμονώδη δράση σε επίμυς, στη βιβλιογραφία αναφέρεται πως απαιτούνται υψηλότερες δόσεις, έως και 1-2 mg kg-1 για τη διαχείριση του μετεγχειρητικού άλγους (Roughan et al. 2003).
Τοπική αναισθησία
Η λιδοκαΐνη και η μπουπιβακαΐνη είναι τα συνηθέστερα τοπικά αναισθητικά που μπορούν να χορηγηθούν τοπικά, με διήθηση και ενδοαρθρικά. Η λιδοκαΐνη έχει ταχεία έναρξη, αλλά μικρή διάρκεια δράσης, ενώ η μπουπιβακαΐνη έχει βραδεία έναρξη, αλλά μεγαλύτερη διάρκεια δράσης. Τα τοπικά αναισθητικά συστήνεται να αραιώνονται σε αραιώσεις 1:2 και 1:4 για να αποφευχθεί η υπερδοσία. Η τοπική διήθηση σε χειρουργικά ή μη τραύματα αποτελεί απλή και οικονομική μέθοδο αναλγησίας για χειρουργικές επεμβάσεις. Η προσθήκη αδρεναλίνης στο διάλυμα της έγχυσης μπορεί να παρατείνει την διάρκεια δράσης των τοπικών αναισθητικών (Wegner 2012, Kluge et al. 2017).
Περιοχική αναλγησία
Η επισκληρίδια αναλγησία (0,1-0,2 ml kg-1) και ο αποκλεισμός του μηριαίου και ισχιακού νεύρου έχουν περιγραφεί στο ινδικό χοιρίδιο, στον επίμυ και στον κόνικλο, για επεμβάσεις στα οπίσθια άκρα. Επίσης, στον κόνικλο και τον επίμυ, η επισκληρίδια αναλγησία χρησιμοποιείται τόσο για διεγχειρητική όσο και για μετεγχειρητική αναλγησία. Σε περίπτωση που απαιτείται παρατεταμένη αναλγησία, μπορεί να τοποθετηθεί επισκληρίδιος καθετήρας για συνεχή ή επαναλαμβανόμενη εφάπαξ χορήγηση (van den Hoogen et al. 1981, Malinovsky et al. 1997, Nishiyama 1998, Dollo et al. 2004, Johnston 2005, Lichtenberger et al. 2007, Wenger 2012, Aguiar et al. 2014).
Επίλογος
Συμπερασματικά, ο κόνικλος και τα κατοικίδια τρωκτικά έχουν αυξημένες απαιτήσεις ως προς την ορθή αντιμετώπισή τους περιεγχειρητικά. Η έμφαση στη μείωση του στρες από την προαναισθητική κιόλας εξέταση, στον έλεγχο των ζωτικών λειτουργιών, στην υποστήριξη του κυκλοφορικού και στη διαχείριση του μετεγχειρητικού πόνου θα δημιουργήσει τις συνθήκες εκείνες που θα συμβάλουν στην επιτυχή έκβαση του χειρουργικού περιστατικού.
Σύγκρουση συμφερόντων
Οι συγγραφείς δηλώνουν ότι δεν υπάρχει σύγκρουση συμφερόντων.
Βιβλιογραφία
- Aguiar J, Mogridge G, Hall J (2014) Femoral fracture repair and sciatic and femoral nerve blocks in a guinea pig. J Small Anim Pract, 55: 635–639.
- Alworth LC, Harvey SB (2012) The laboratory rabbit, guinea pig, hamster, and other rodents. 1st ed. American College of Laboratory Animal Medicine, Academic Press (Elsevier), San Diego, pp. 955–965.
- Bannon AW, Malmberg AB (2007) Models of nociception: hotplate, tail-flick, and formalin tests in rodents. Current Protocols in Neuroscience 8, 8-9.
- Barter LS (2011) Rabbit analgesia. Vet Clin North Am Exotic Anim Practice 14, 93-104.
- Bellini L, Veladiano IA, Schrank M, Candaten M, Mollo A (2018) Prospective clinical study to evaluate an oscillometric blood pressure monitor in pet rabbits. BMC Vet Res 14, 52-60.
- Benato L, Rooney N, Murrell JC (2019) Pain and analgesia in pet rabbits within the veterinary environment: a review. Vet Anaesth Analg 46, 151-162.
- Berry HS (2015) Analgesia in the Perioperative Period. Vet Clin North Am Small Anim Pract 45, 1013-1027.
- Bourque SL, Adams MA, Nakatsu K (2010) Comparison of buprenorphine and meloxicam for post-surgical analgesia in rats: effects on body weight, locomotor activity. J Am Assoc Lab Anim Sci 49, 617–622.
- Brodbeld D (2009) Perioperative mortality in small animal anaesthesia. Vet J 182, 152-160.
- Cannon B and Nedergaard J (2011) Nonshivering thermogenesis and its adequate measurement in metabolic studies. J Exp Biol 214, 242–253.
- Cao J, Du Y, Wang YJ et al. (2018) Pharmacokinetics of meperidine (pethidine) in rabbit oral fluid: correlation with plasma concentrations after controlled administration. Pharmazie, 73, 324- 328.
- Carpenter JW, Pollock CG, Koch DE (2009) Single and multipledose pharmacokinetics of meloxicam after oral administration to the rabbit (Oryctolagus cuniculus). J Zoo Wildl Med, 40, 601–606.
- Cruz F and Junquera J (1993) The immobility response elicited by clamping, bandaging and grasping in the Mongolian gerbil (Meriones unguiculatus). Behav Brain Res 54, 165-169.
- Coulter CA, Flecknell PA, Leach MC, Ritsardson CA (2011) Reported analgesic administration to rabbits undergoing experimental surgical procedures. Vet Res 7, 12-18.
- Deuis JR, Dvorakova LS, Vetter I (2017) Methods Used to Evaluate Pain Behaviors in Rodents. Front Mol Neurosci 10, 284-300.
- Dollo G, Malinovsky JM, Péron A et al. (2004) Prolongation of epidural bupivacaine effects with hyaluronic acid in rabbits. Int J Phar 19, 109-119.
- Edis A (2016) How to manage intraosseous catheters in exotic species. The Veterinary Nurse 7, 589–593.
- Egger CM, Souza MJ, Greenacre CB, Cox SK, Rohrbach BW (2009) Effect of intravenous administration of tramadol hydrochloride on the minimum alveolar concentration of isoflurane in rabbits. Am J Vet Res 70, 945-949.
- Erkert RS, MacAllister CG (2005) Use of a eutectic mixture of lidocaine 2.5% and prilocaine 2.5% as a local anesthetic in animals. J Am Vet Med Assoc 226, 1990–1992.
- Flecknell P (2018) Rodent analgesia: Assessment and therapeutics. Vet J 232, 70-77.
- Flecknell P (2002) Guinea pig. In: BSAVA manual of exotic pets. (4th edn), BSAVA, Hampshire, pp. 54-64.
- Flecknell P (2006) Anaesthesia and perioperative care. In: Meredith A, Flecknell P, eds. BSAVA Manual of Rabbit Medicine and Surgery. Quedgeley, UK, pp: 154–165.
- Fredholm DV, Carpenter JW, KuKanich B (2013) Pharmacokinetics of meloxicam in rabbits after oral administration of single and multiple doses. Am J Vet Res 74, 636–641.
- Gad SC, Spainhour CB, Shoemake C et al. (2016) Tolerable Levels of Nonclinical Vehicles and Formulations Used in Studies by Multiple Routes in Multiple Species with Notes on Methods to Improve Utility. Int J Toxicol 35, 95-178.
- Gades NM, Danneman, PJ, Wixson, SK (2000) The magnitude and duration of the analgesic effect of morphine, butorphanol, and buprenorphine in rats and mice. Contemp Top Lab Anim Sci 39, 8–13.
- Gaskil B and Garner JP (2017) Stressed out: providing laboratory animals with behavioral control to reduce the physiological effects of stress. Lab Animal 46, 142–145.
- Goodman G (2002) Hamster. In: BSAVA manual of exotic pets. (4th edn), BSAVA, Hampshire, pp. 27-33.
- Hampshire V, Robertson S (2015) Using the facial grimace scale to evaluate rabbit wellness in post-procedural monitoring. Lab Animal 4, 259-260.
- Harkness JE, Wagner JE (1995) The Biology and Medicine of Rabbits and Rodents, 4th ed, Williams & Wilkins, pp. 65-73.
- Harvey L, Knowles T, Murison P (2012) Comparison of direct and Doppler arterial blood pressure measurements in rabbits during isoflurane anaesthesia. Anesth Analg 39, 174-184.
- Hawkins MG (2006) The use of analgesics in birds, reptiles, and small exotic animals. J Exotic Pet Med 15, 177-192.
- Johnston MS (2005) Clinical Approaches to Analgesia in Ferrets and Rabbits. In: Proceedings of Seminars in Avian and Exotic Pet Medicine 14, 229-235.
- Kazakos GM, Anagnostou T, Savvas I, Raptopoulos D, Psalla D, Kazakou IM (2007) Use of the laryngeal mask airway in rabbits: placement and efficacy. Lab Anim 36, 29-34.
- Kazakos GM, Savvas I, Anagnostou T, Flouraki E, Pavlidou K, Sapanidou V (2010) Use of a eutectic mixture of lidocaine 2.5% and prilocaine 2.5% as a local anaesthetic for arterial catheterisation in rabbits. Vet Anaesth Analg 38, 27–28.
- Keating SCJ, Thomas AA, Flecknell PA, Leach MC (2012) Evaluation of EMLA Cream for Preventing Pain during Tattooing of Rabbits: Changes in Physiological, Behavioural and Facial Expression Responses. PLoS ONE 7, 1-11.
- Keeble E (2002) Gerbil. In: BSAVA manual of exotic pets. (4th edn), BSAVA, Hampshire, pp. 35-36.
- Klaus U, Weinandy R, Gattermann R (2000) Circadian activity rhythms and sensitivity to noise in the Mongolian gerbil (Meriones unguiculatus). Chronobiology International 17, 137–145.
- Kohn DF, Martin TE, Foley PL, Morris TH, M Swindle M, Vogler GA, Wixson S (2007) Guidelines for the Assessment and Management of Pain in Rodents and Rabbits, J Am Ass Lab Anim Science 46, 97-108.
- Kluge K, Larenza Menzies MP, Kloeppel H, Pearce SG, Bettschart- Wolfensberger R, Kutter AP (2017) Femoral and sciatic nerve blockades and incision site infiltration in rabbits undergoing stifle joint arthrotomy. Lab Anim 51, 54-64.
- Kula A, Akkar OB, Gulturk S, Cetin M, Cetin A (2016) Combination of paracetamol or ketamine with meperidine enhances antinociception. Hum Exp Toxicol 35, 887-892
- Langford DJ, Bailey AL, Chanda ML et al. (2010) Coding of facial expressions of pain in the laboratory mouse. Nature Methods 7, 447-449.
- Leach MC, Allweiler S, Richardson C (2009) Behavioural effects of ovariohysterectomy and oral administration of meloxicam in laboratory housed rabbit. Res Vet Sci 87, 336-347.
- Lennox AM (2008) Intraosseous Catheterization of Exotic Animals. Journal of Exotic Pet Medicine 17, 300–306.
- Lichtenberger M, Ko J, (2007) Anesthesia and analgesia for small mammals and birds. Vet Clin N Am Exotic Anim Pract 10, 293-315.
- Malinovsky, JM, Bernard JM, Baudrimont M, Dumand JB Lepage JY (1997) A chronic model for experimental investigation of epidural anesthesia in the rabbit. Regional Anesthesia, 22, 80-85.
- Meredith A (2015) BSAVA Small Animal Formulary. Part B: Exotic pets. (9th edn), BSAVA, Hampshire, UK.
- Miller AL, Leach, MC (2015) The mouse grimace scale: a clinically useful tool? PLoS ONE 10, e0136000.
- Monson CB, Oyama J (1984) Core temperature of tailless rats exposed to centrifugation. Physiologist, 27, 97-98.
- Morton D, Safron JA, Glosson J, Rice DW, Wilson DM, White RD (1997) Histologic lesions associated with intravenous infusions of large volumes of isotonic saline solution in rats for 30 days. Toxicol Pathol 25, 390–394.
- Morton DB, Jennings M, Buckwell A et al. (2001) Refining procedures for the administration of substances. Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. British Veterinary Association Animal Welfare Foundation/Fund for the Replacement of Animals in Medical Experiments/Royal Society for the Prevention of Cruelty to Animals/Universities Federation for Animal Welfare. Lab Anim 35, 1–41.
- Navarrete-Calvo R, Gómez-Villamandos RJ, Morgaz J et al. (2014) Cardiorespiratory, anaesthetic and recovery effects of morphine combined with medetomidine and alfaxalone in rabbits.Vet Rec 174, 95-100.
- Nishiyama T (1998) A rat model of chronic lumbar epidural catheterization. Can J Anaesth, 45, 907–912.
- Orr HE (2002) Rats and Mice. In: BSAVA manual of exotic pets. (4th edn), BSAVA, Hampshire, pp. 16-17.
- Owens NC, Ootsuka Y, Kanosue K, McAllen RM (2002) Thermoregulatory control of sympathetic fibres supplying the rat’s tail. J Physiol 543, 849–858.
- Quesenberry K and Carpenter J (2012) Ferrets, Rabbits, and Rodents, Clinical Medicine and Surgery (3rd ed). Elsevier, Missouri, pp. 429-451.
- Roughan JV and Flecknell PA (2003) Evaluation of a short duration behaviour-based post-operative pain scoring system in rats. Eur J of Pain 7, 397-406.
- Smiler KL, Stein S, Hrapkiewicz KL, Hiben JR (1990) Tissue response to intramuscular and intraperitoneal injections of ketamine and xylazine in rats. Lab Anim Sci 40, 60–64.
- Souza MJ, Greenacre CB, Cox SK (2008) Pharmacokinetics of orally administered tramadol in domestic rabbits (Oryctolagus cuniculus), Am J Vet Res 69, 979-982.
- Stokes EL, Flecknell PA, Richardson CA (2009) Reported analgesic and anaesthetic administration to rodents undergoing experimental surgical procedures. Lab Anim 43, 149-154.
- Swisher S, Lennox A (2015) Analgesia in Small Exotic Mammals: A review. Advances in Small Animal Medicine and Surgery 28, 1-3.
- Tran AN and Koo JY (2014) Risk of systemic toxicity with topical lidocaine/prilocaine: a review. J Drugs Dermatol 13,118-122.
- Tranquilli WJ, Thurmon JC, Grimm, KA (2007) Lumb and Jones’ Veterinary Anesthesia and Analgesia, 4th ed, Blackwell, Iowa, USA, pp. 765-785.
- Turner PV, Brabb T, Pekow C, Vasbinder M (2011) Administration of Substances to Laboratory Animals: Routes of Administration and Factors to Consider. J Am Assoc Lab Anim Sci 50, 600–613.
- Uchida S, Hara K, Kobayashi A, Funato H, Hobara T et al. (2010) Early life stress enhances behavioral vulnerability to stress through the activation of REST4-mediated gene transcription in the medial prefrontal cortex of rodents. J Neurosci Res 30, 15007–15018.
- Van den Hoogen RH, Colpaert FC (1981) Long term catheterization of the lumbar epidural space in rats. Pharmacol Biochem Behav 15, 515–516.
- Wagner JE (2014) The Biology of the Guinea Pig. Academic Press, pp. 5- 13.
- Wenger S (2012) Anesthesia and analgesia in rabbits and rodents. Journal of Exotic Pet Medicine 21, 7–16.
- Wilson DM, Romero JC, Strong CG et al. (1975) Indirect blood pressure measurements in the rabbit: correlations with direct aortic and ear pressures. J Lab Clin Med 86, 1032–1039.
- Woolf, CJ and Chong MS (1993) Preemptive analgesia–treating postoperative pain by preventing the establishment of central sensitization. Anesth Analg 77, 362–379.
- Wurbel H (2001) Ideal homes? Housing effects on rodent brain and behavior. Trends in Neuroscience 24, 207- 211.
- Ypsilantis, P, Didilis, VN, Politou, M et al. (2000) A comparative study of invasive and oscillometric methods of arterial blood pressure measurement in the anesthetized rabbit. Res Vet Sci 78, 269–275.
Υπεύθυνη αλληλογραφίας:
Παναγιώτα Καραμιχάλη
e-mail: Αυτή η διεύθυνση ηλεκτρονικού ταχυδρομείου προστατεύεται από τους αυτοματισμούς αποστολέων ανεπιθύμητων μηνυμάτων. Χρειάζεται να ενεργοποιήσετε τη JavaScript για να μπορέσετε να τη δείτε.



