ένα αναδυόμενο κροτωνογενές λοιμώδες νόσημα
> Περίληψη
Το Anaplasma phagocytophilum, που είναι ενδοκυτταρικό, Gram-αρνητικό και αερόβιο βακτήριο, προκαλεί την κοκκιοκυτταρική αναπλάσμωση του ανθρώπου, του αλόγου, του σκύλου, της γάτας, του λύκου, των βοοειδών και των μικρών μηρυκαστικών. Το A. phagocytophilum έχει τροπισμό στα ουδετερόφιλα και σπανιότερα στα εωσινόφιλα κοκκιοκύτταρα και στην Ευρώπη μεταδίδεται με τον κρότωνα Ixodes ricinus. Ένας σημαντικός αριθμός μικρών θηλαστικών και ελαφοειδών αποτελούν τη δεξαμενή του μικροοργανισμού στη φύση. Οι περισσότεροι μολυσμένοι σκύλοι παραμένουν ασυμπτωματικοί, ενώ η πλειονότητα εκείνων που νοσούν, παρουσιάζει μη ειδική συμπτωματολογία, όπως πυρετό, κατάπτωση ή λήθαργο, ανορεξία και χωλότητα. Το συχνότερο εργαστηριακό εύρημα της αναπλάσμωσης είναι η θρομβοκυτταροπενία. Η διάγνωση στηρίζεται στην ανεύρεση των συσσωματωμάτων του μικροοργανισμού (μορίδια) στο κυτταρόπλασμα των ουδετερόφιλων κυττάρων, την ορολογική ανίχνευση των ειδικών αντισωμάτων και την αλυσιδωτή αντίδραση της πολυμεράσης. Η θεραπεία εκλογής είναι η δοξυκυκλίνη, που χορηγείται στη δόση των 5 mg/kg Σ.Β./12ωρο, από το στόμα, για 2-4 εβδομάδες.
> Αιτιολογία
Η κοκκιοκυτταρική αναπλάσμωση (ΚΑ) του σκύλου οφείλεται στο βακτήριο Anaplasma phagocytophilum (τάξη: Rickettsiales, οικογένεια: Anaplasmataceae). Παλαιότερα, ο μικροοργα- νισμός αυτός αναφέρονταν ως Ehrlichia equi, A. phagocytophila ή αιτιολογικός παράγοντας της κοκκιοκυτταρικής ερλιχίωσης του ανθρώπου, αλλά μετονομάστηκε σε A. phagocytophilum μετά την πρόσφατη τροποποίηση στην ταξινόμηση των ειδών των οικογενειών Rickettsiaceae και Anaplasmataceae, που στηρίχθηκε στη νουκλεοτιδική αλληλουχία των γονιδίων 16S rRNA και groESL.1-3 Το A. phagocytophilum περιλαμβάνει πολυάριθμα στελέχη που διαφέρουν ως προς τη γεωγραφική τους κατανομή, τα ζωικά είδη που προσβάλλουν και τη λοιμογόνο δράση τους. Για παράδειγμα, στελέχη που απομονώθηκαν στην Ευρώπη, δεν προκαλούν πειραματική νόσο στο άλογο και στελέχη που απομονώθηκαν από ανθρώπους στις Η.Π.Α. απέτυχαν να προκαλέσουν νόσο στα βοοειδή.4 Επιπλέον, η νοσηρότητα και η θνησιμότητα της ΚΑ του ανθρώπου στην Ευρώπη φαίνεται ότι είναι μικρότερη σε σύγκριση με τις Η.Π.Α.5 Το A. phagocytophilum είναι gram-αρνητικό, αερόβιο και υποχρεωτικά ενδοκυτταρικό βακτήριο, με κοκκοειδή ή ελλειψοειδή μορφή, διάμετρο 0.2- 2.0 μm και τροπισμό κυρίως στα ουδετερόφιλα και σπάνια στα εωσινόφιλα κοκκιοκύτταρα. Οι μικροοργανισμοί εντοπίζονται στο κυτταρόπλασμα των μολυσμένων κυττάρων, μέσα σε κενοτόπια που σχηματίζονται από την κυτταρική μεμβράνη και στα οποία διαιρούνται με διχοτόμηση, παράγοντας 20 ή περισσότερα βακτήρια. Τα τελευταία συσσωματώνονται, δημιουργώντας έτσι το τυπικό μορίδιο (morula) που έχει διάμετρο 1.5-2.5 μm.6
> Επιζωοτιολογία
Μόλυνση από A. phagocytophilum έχει διαπιστωθεί, μέχρι σήμερα, μόνο στο Βόρειο ημισφαίριο, όπου οι κρότωνες του γένους Ixodes (σύμπλεγμα του I. persulcatus) είναι οι κύριοι ενδιάμεσοι ξενιστές του.6,7 Στην Ευρώπη, ο βασικός υπεύθυνος κρότωνας είναι ο I. ricinus, χωρίς βέβαια να μπορεί να αποκλειστεί ο ρόλος και άλλων ειδών κροτώνων. Για παράδειγμα στη Σαρδηνία, με την αλυσιδωτή αντίδραση της πολυμεράσης (PCR) βρέθηκε σε ένα από τους 50 (2%) κρότωνες του είδους Rhipicephalus sanguineus που εξετάστηκαν.8 Το βακτήριο μεταδίδεται διασταδιακά στους κρότωνες3,9 και στις φυσικές του δεξαμενές περιλαμβάνονται πολυάριθμα είδη, κυρίως όμως τα άγρια τρωκτικά και μηρυκαστικά (ελαφοειδή).1
Το A. phagocytophilum έχει ανιχνευθεί με την PCR σε διάφορα είδη θηλαστικών σε όλες σχεδόν τις Ευρωπαϊκές χώρες. Εκτός από τα κατοικίδια μηρυκαστικά, έχει βρεθεί στο σκύλο, τη γάτα, το άλογο, τον όνο, τον ευρωπαϊκό βούβαλο, το κόκ- κινο ελάφι, την άλκη, το ζαρκάδι, τον αγριόχοιρο, το λύκο, τον Ευρασιατικό λύγκα, την κόκκινη αλεπού, το λαγό, τα μικρά τρωκτικά και τον άνθρωπο.10, 11 Όμως η νόσος (ΚΑ) έχει τεκμηριωθεί μόνο σε σκύλους, γάτες, άλογα, αγελάδες, πρόβατα, αίγες, ανθρώπους6 και πρόσφατα σε λύκους.6,10 Επισημαίνεται ότι επειδή ο σκύλος και ο άνθρωπος είναι τυχαίοι ξενιστές και εμφανίζουν μικρής διάρκειας βακτηριαιμία (<28 ημέρες), ο ρόλος τους ως δεξαμενών του βακτηρίου δε φαίνεται να είναι σημαντικός.12 Αντίθετα, τα αποδημητικά πτηνά ενδέχεται να έχουν μεγάλη επιζωοτιολογική σημασία μέσω της διασποράς των μολυσμένων κροτώνων σε μακρινές αποστάσεις.6,13-15
Σε σπάνιες περιπτώσεις, η μετάδοση του A. phagocytophilum μπορεί να επιτευχθεί χωρίς τη μεσολάβηση κροτώνων.7 Αυτό μπορεί να συμβεί με τον πειραματικό ενοφθαλμισμό ή τη μετάγγιση αίματος. Επιπλέον, έχει, αναφερθεί ενδονοσοκομειακή καθώς και μόλυνση ανθρώπων από σφάγια ελαφιών κατά τη διάρκεια της εκδοράς.7,16 Η μετάδοση μέσω του πλακούντα έχει αποδειχθεί στις αγελάδες, στις οποίες το A. phagocytophilum έχει βρεθεί επιπλέον και στα λευκά αιμοσφαίρια του γάλακτος, ύστερα από πειραματική μόλυν- ση.17,18 Όμως, σε πρόσφατο περιστατικό κυοφο- ρούσας σκύλας με ΚΑ, δε διαπιστώθηκε περιγεννητική μετάδοση του βακτηρίου σε κανένα από τα πέντε κουτάβια της τοκετομάδας.19
Η συχνότητα μόλυνσης του σκύλου από το A. phagocytophilum έχει μελετηθεί εκτενώς με βάση τις ορολογικές εξετάσεις, ενώ αντίθετα είναι ελάχιστες οι επιζωοτιολογικές μελέτες που στηρίζο- νται στις μοριακές. Η σύγκριση των αποτελεσμά- των μεταξύ διαφορετικών μελετών είναι δύσκολη, λόγω των σημαντικών διαφορών στο σχεδιασμό τους (π.χ. εξέταση δειγμάτων από υγιείς ή άρρω- στους σκύλους, από σκύλους που προσκομίσθηκαν σε κτηνιατρεία πρωτοβάθμιας περίθαλψης ή σε κλινικές δεύτερης γνώμης, εποχή δειγματοληψίας).6 Επιπλέον, η οροθετικότητα δεν αντανακλά αποκλειστικά την έκθεση των σκύλων στο A. phagocytophilum, καθώς μπορεί να υπάρχουν διασταυρούμενες αντιδράσεις με άλλα είδη αναπλασμάτων, όπως το A. platys.7 Παρά τους παραπάνω περιορισμούς, τα ποσοστά των οροθετικών σκύλων σε διάφορες Ευρωπαϊκές χώρες κυμαίνονται από 5% μέχρι και 70.5%,6 γεγονός που κάνει την ΚΑ του σκύλου ένα σημαντικό αναδυόμενο κροτωνογενές λοιμώδες νόσημα. Επιπλέον, έχουν αναφερθεί κλινικά περιστατικά ΚΑ στη Αυστρία,20 τη Γαλλία,21 τη Γερμανία,22 την Ελβετία,23 το Ηνωμένο Βασίλειο,24 την Ισπανία,25 την Ιταλία,26,27 την Πολωνία,28 την Πορτογαλία,29 τη Σλοβακία,30 τη Σλοβενία 31,32 και τη Σουηδία.33,34 Στη χώρα μας, η ΚΑ έχει διαγνωστεί σε ορισμένους σκύλους, με βάση κυτταρολογικές, ορολογικές και μοριακές εξετάσεις,35,36 ενώ πρόσφατα διαπιστώθηκε αιμορραγική διάθεση σε κριάρι που αποδόθηκε σε μόλυνση από A. phagocytophilum με βάση το αποτέλεσμα της ορολογικής εξέτασης.37 Τέλος, το DNA του Α. phagocytophilum έχει ανιχνευτεί σε κρότωνες I. ricinus.38
Η μόλυνση του σκύλου από το A. Phagocytophilum και η εκδήλωση των συμπτωμάτων της ΚΑ εξαρ- τώνται από την εποχή του έτους, την ηλικία, τη φυλή και τις συνυπάρχουσες μολύνσεις.7 Στις Η.Π.Α. η ΚΑ διαπιστώνεται συχνότερα από την άνοιξη μέχρι τις αρχές του καλοκαιριού καθώς και το φθινόπωρο,6 ενώ στη Γερμανία η διάγνωσή της στους 17 από τους 18 σκύλους έγινε με- ταξύ Απριλίου και Σεπτεμβρίου.39 Το ποσοστό των οροθετικών σκύλων αυξάνει με την ηλικία 40 και η μέση ηλικία των σκύλων με ΚΑ κυμαίνεται μεταξύ 6 και 8 ετών.34,39,41,42 Περίπου οι μισοί μολυσμένοι σκύλοι σε μία μελέτη ανήκαν στη φυλή Golden retriever, ενώ σε άλλες έρευνες δε διαπιστώθηκε προδιάθεση ως προς τη φυλή.34 Οι συνυπάρχουσες αρθροποδογενείς μολύνσεις μπορούν να επηρεάσουν την κλινική και εργαστηριακή εικόνα του νοσήματος.7 Οι σύμμικτες μολύνσεις από A. phagocytophilum και Borrelia burgdorferi sensu lato είναι συχνές τόσο στη Βόρεια Αμερική 6 όσο και την Ευρώπη43-46, αφού και οι δύο αυτοί μικρο- οργανισμοί μεταδίδονται με τον ίδιο κρότωνα. Σχετικά συχνές είναι επίσης οι σύμμικτες μολύνσεις με μικροοργανισμούς των γενών Ehrlichia, Bartonella, Rickettsia και Babesia.7
> Παθογένεια
Οι κρότωνες του γένους Ixodes χρειάζονται από 24 έως και 48 ώρες από την προσκόλλησή τους μέχρι να ενοφθαλμίσουν το A. phagocytophilum στον ξενιστή. Το βακτήριο διαθέτει σύνθετους μηχανισμούς αποφυγής της άμυνας των ουδετερόφιλων. Συγκεκριμένα, αφού προσκολληθεί στα κύτταρα αυτά μέσω της P-σελεκτίνης (CD62-P) και εισέλθει στο κυτταρόπλασμα με ενδοκυττάρωση, τροποποιεί, με στόχο την επιβίωση και τον πολλαπλασιασμό του, ορισμένες βασικές λειτουργίες του ουδετερόφιλου. Έτσι, αναστέλλει τη φαγολυσοσωματική οδό και την παραγωγή υπεροξειδίου του υδρογόνου στα φαγοσωμάτια, μειώνει τη φαγοκυτταρική ικανότητα και την προσκόλληση των ουδετερόφιλων στο ενδοθήλιο των αγγείων και καθυστερεί την απόπτωση των μολυσμένων ουδετερόφιλων.7 Η περίοδος επώασης της νόσου κυμαίνεται από 1 ως 2 εβδομάδες και οι υπεύθυνοι παθογενετικοί μηχανισμοί δεν έχουν διευκρινιστεί πλήρως. Σε αυτούς ενδέχεται να περιλαμβάνονται η μυελοκαταστολή από τις κυτταροκίνες που παράγονται, οι διαταραχές της ωρίμανσης των πρόδρομων αιμοποιητικών κυττάρων στο μυελό των οστών, η ανοσολογική καταστροφή των αιμοσφαιρίων, η δυσλειτουργία των ουδετερόφιλων και η υπερκατανάλωση των αιμοπεταλίων.6
> Κλινική εικόνα και εργαστηριακά ευρήματα
Οι περισσότεροι μολυσμένοι σκύλοι παραμένουν κλινικά υγιείς,7 ενώ σε αντίθετη περίπτωση διαπιστώνονται συμπτώματα της οξείας νόσου. Αν και πολλοί σκύλοι παραμένουν υποκλινικοί φορείς του μικροοργανισμού για αρκετούς μήνες, χρόνια νόσος ανάλογη με εκείνη της μονοκυτταρικής ερλιχίωσης (Ε. canis) του σκύλου δεν έχει αποδειχθεί στην περίπτωση της ΚΑ. Επιπλέον, μέχρι σήμερα, δεν έχουν αναφερθεί θανατηφόρα περιστατικά ΚΑ στο σκύλο.6
Τα συχνότερα συμπτώματα της ΚΑ του σκύλου (Πίνακας 1) είναι ο πυρετός και η κατάπτωση ή ο λήθαργος που διαπιστώνονται στο 90% περίπου των περιστατικών,34,39,41,47,48 ενώ ιδιαίτερα συχνή είναι και η ανορεξία.41,42 48 Η περιφερική λεμφογαγγλιομεγαλία διαπιστώνεται στο 5-30% περίπου των περιστατικών, και η σπληνομεγαλία σε ποσοστό που κυμαίνεται από 10 μέχρι και 100%, ανάλογα με τη μελέτη.49 Χωλότητα λόγω πολυαρθρίτιδας, απροθυμία μετακίνησης και μυοσκελετικό άλγος αναφέρονται σχετικά συχνά,41,50 ενώ στις σπανιότερες κλινικές εκδηλώσεις περιλαμβάνονται οι έμετοι, η διάρροια, το κοιλιακό άλγος,50-52 η πολυουρία, η πολυδιψία, η ταχύπνοια, η δύσπνοια, ο βήχας, η αιμορραγική διάθεση, η ραγοειδίτιδα και διάφορες νευρικές διαταραχές (επιληπτικές κρίσεις, αταξία, αιθουσαίο σύνδρομο, συμπτώματα μηνιγγίτιδας).
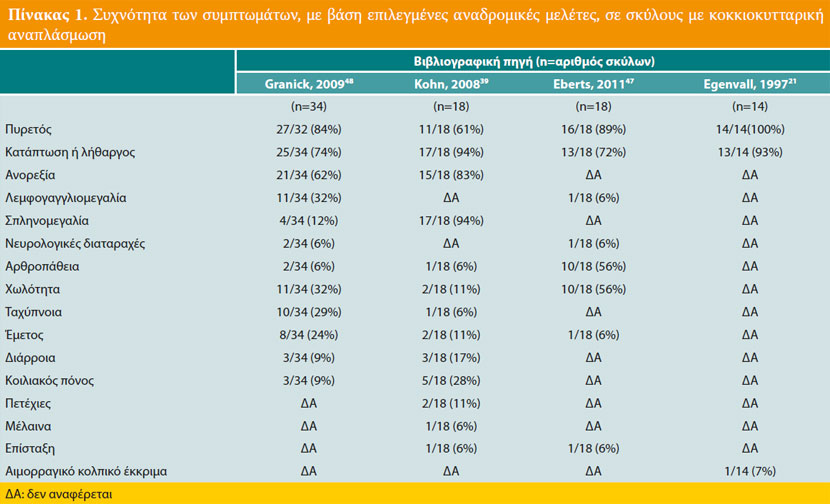
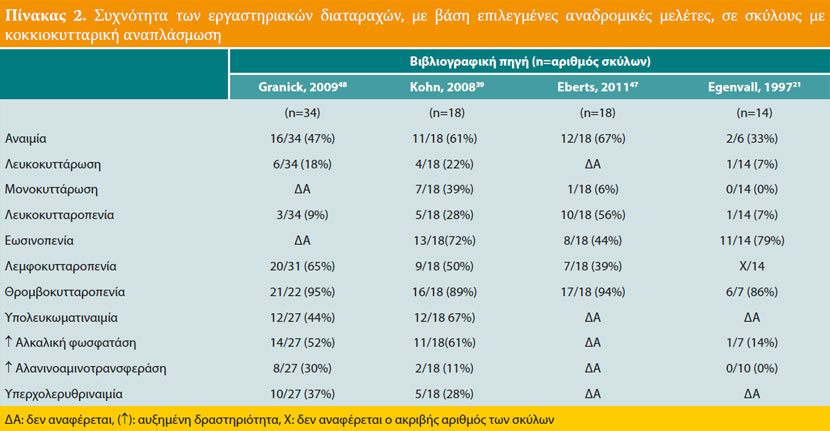
Η θρομβοκυτταροπενία είναι η συχνότερη αιματολογική διαταραχή και διαπιστώνεται στο 90% περίπου των προσβεβλημένων σκύλων (Πίνακας 2). Η ήπια μη αναγεννητική αναιμία, η αύξηση ή μείωση του αριθμού των λευκών αιμοσφαιρίων, η λεμφοκυτταροπενία, η ουδετεροφιλία και η ουδετεροπενία διαπιστώνονται λιγότερο συχνά. Η υπολευκωματιναιμία, η υπερσφαιριναιμία και η ήπια αύξηση της δραστηριότητας των ηπατικών ενζύμων (αλκαλική φωσφατάση και αλανινοαμινοτρανσφεράση), αποτελούν τις κυριότερες βιοχημικές διαταραχές, ενώ, λιγότερο συχνή είναι η υπερχολερυθριναιμία.39,41,42,47,48
> Διάγνωση
Εκτός από το ιστορικό (π.χ. πρόσφατη έκθεση σε κρότωνες) και τη συμβατή κλινική και εργαστηριακή εικόνα, η διάγνωση της ΚΑ επιβεβαιώνεται όταν πληρείται ένα τουλάχιστον από τα παρακάτω κριτήρια, που αποτελούν άλλωστε τη βάση του διαγνωστικού αλγόριθμου της ΚΑ στον άνθρωπο:7 (α) εντόπιση των μοριδίων μέσα στα ουδετερόφιλα σε συνδυασμό με τίτλο ειδικών αντισωμάτων με τη μέθοδο του έμμεσου ανοσοφθορισμού (IFA) ≥1/80, (β) τετραπλασιασμός του τίτλου των αντισωμάτων σε ζεύγος ορών που λαμβάνονται σε μεσοδιάστημα 3-4 εβδομάδων, (γ) θετική PCR χρησιμοποιώντας ειδικούς για το A. phagocytophilum εκκινητές, ή (δ) απομόνωση του A. phagocytophilum από το αίμα ύστερα από καλλιέργεια σε ειδικές κυτταρικές σειρές.12
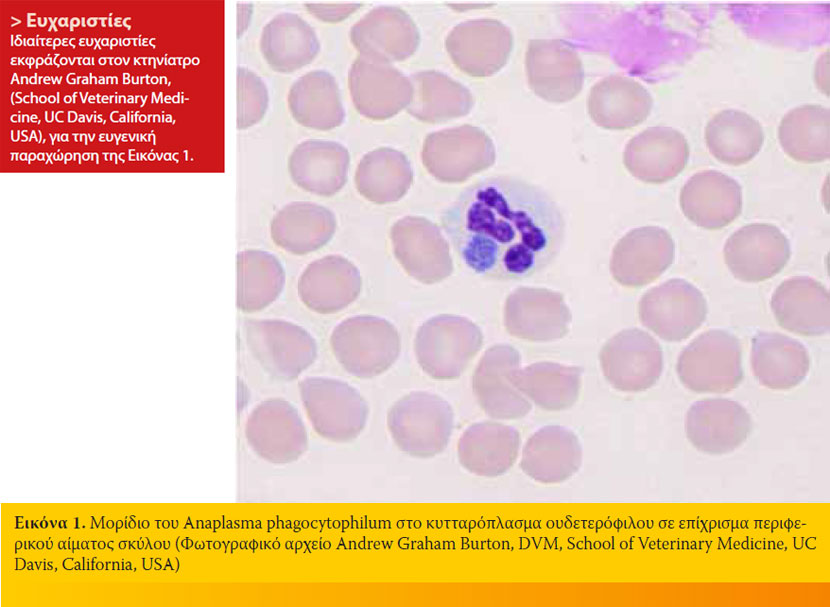
Η κυτταρολογική εξέταση των επιχρισμάτων από το περιφερικό αίμα ή τη στοιβάδα λευκών αιμοσφαιρίων-αιμοπεταλίων του αιματοκρίτη με χρώσεις τύπου Romanowsky (π.χ. Diff-Quik, Giemsa) έχει μεγάλη διαγνωστική ευαισθησία στα αρχικά στάδια της ΚΑ, αφού τα μορίδια (Εικόνα 1) βρίσκονται μέχρι και στο 32% των ουδετερόφιλων.35 Τα μορίδια εμφανίζονται 4 ημέρες μετά την πειραματική μόλυνση του σκύλου και παραμένουν σε μεγάλους αριθμούς για 4-8 ημέρες. Η διάκριση των μοριδίων του A. phagocytophilum από εκείνα της Ehrlichia ewingii, που επίσης εντοπίζονται στα ουδετερόφιλα, είναι αδύνατη στο οπτικό μικροσκόπιο και μπορεί να γίνει μόνο με την PCR.7
Στην κλινική πράξη, η διάγνωση της ΚΑ στηρίζεται συχνά στην ανίχνευση των ειδικών αντισωμάτων σε ζεύγος ορών που πάρθηκαν σε μεσοδιάστημα 3-4 εβδομάδων, αφού ο τετραπλασιασμός του τίτλου είναι ισχυρά ενδεικτικός της ενεργού μόλυνσης. Αντίθετα, οι μεμονωμένοι θετικοί τίτλοι αντισωμάτων δεν επιβεβαιώνουν την ενεργό μόλυνση, αφού μπορεί να οφείλονται σε παλαιότερη μόλυνση από το A. phagocytophilum και στη μακροχρόνια παραμονή τους (μέχρι και 12 μήνες) μετά την εκρίζωσή της (θεραπεία ή αυτοΐαση). Επιπλέον, επισημαίνεται ότι στην ΚΑ η εκδήλωση των συμπτωμάτων ενδέχεται να προηγηθεί της εμφάνισης ανιχνεύσιμου τίτλου αντισωμάτων.7 Για παράδειγμα, με τη δοκιμή IFA οι IgG ανοσοσφαιρίνες ανιχνεύονται 8 περίπου ημέρες μετά τη μόλυνση και 2-5 ημέρες μετά την εμφάνιση των μοριδίων στα ουδετερόφιλα. Σήμερα είναι εμπορικά διαθέσιμη και μια πραγματοποιήσιμη στο χώρο του κτηνιατρείου (in-clinic) ανοσοενζυμική ορολογική δοκιμή (ELISA), η οποία χρησιμοποιεί την ανασυνδυασμένη πρωτεΐνη Msp2/p44 για την ποιοτική εκτίμηση (θετικό ή αρνητικό αποτέλεσμα) της παρουσίας ή όχι αντισωμάτων έναντι του A. phagocytophilum.53 Με τη δοκιμή αυτή, παρατηρούνται διασταυρούμενες αντιδράσεις μεταξύ του A. phagocytophilum και του A. platys, αλλά όχι με την E. canis.53,54
Η συμβατική PCR και η PCR πραγματικού χρόνου (real-time PCR), σε συνδυασμό με αλληλούχιση των νουκλεοτιδίων, έχουν μεγάλη διαγνωστική ευαισθησία και ειδικότητα και χρησιμοποιούνται για την ανίχνευση του DNA του A. phagocytophilum, στο αίμα, το μυελό των οστών και το σπλήνα.7 Το αρνητικό αποτέλεσμα δεν αποκλείει τη μόλυνση, αφού ο αριθμός των βακτηρίων στο δείγμα ενδέχεται να είναι μικρότερος από το όριο της διαγνωστικής ευαισθησίας της μεθόδου, γεγονός ιδιαίτερα πιθανό μετά τη χορήγηση αντιμικροβιακής αγωγής.16
Το A. phagocytophilum μπορεί να απομονωθεί από το αίμα με καλλιέργεια σε κυτταρικές σειρές προμυελοκυτταρικής λευχαιμίας ανθρώπου (HL-60) ή σε εμβρυϊκές κυτταρικές σειρές κρότωνα. Η μέθοδος αυτή, αν και είναι πολύ μεγάλης διαγνωστικής ευαισθησίας, βρίσκει κυρίως ερευνητική και όχι κλινική εφαρμογή.7
> Θεραπεία και πρόγνωση
Η θεραπεία εκλογής για την ΚΑ του σκύλου θεω- ρείται η δοξυκυκλίνη, στη δόση των 5 mg/kg Σ.Β., από το στόμα, κάθε 12 ώρες, για 2-4 εβδομάδες.6,7 Οι περισσότεροι σκύλοι, παρουσιάζουν κλινική βελτίωση μέσα σε 24-48 ώρες από την έναρξη της αγωγής,7 χωρίς να έχει αποσαφηνιστεί μέχρι σήμερα αν αυτή οδηγεί σε μικροβιολογική ίαση. Άλλα αντιμικροβιακά με τα οποία επιτυγχάνεται κλινική βελτίωση είναι οι φθοριοκινολόνες (π.χ. ενροφλοξασίνη, λεβοφλοξασίνη) 6,16 και η ριφαμπικίνη που έχει χρησιμοποιηθεί και στην αντίστοιχη νόσο του ανθρώπου.16
Επειδή δεν υπάρχει εμβόλιο για το A. phagocytophilum,η πρόληψη βασίζεται στην αποφυγή έκθεσης των σκύλων στους κρότωνες, στη μηχανική απομάκρυνσή τους με ειδική λαβίδα, την τακτική χρήση εξωπαρασιτοκτόνων (π.χ. φιπρονίλη, αμιτράζη, πυρεθρινοειδή) και ενδεχο μένως στην ολιγοήμερη προληπτική χρήση δοξυκυκλίνης όταν ο σκύλος ταξιδεύει σε ενδημικές περιοχές.6,16,22,55
> Σημασία για τη δημόσια υγεία
Η ΚΑ του ανθρώπου, είναι ένα σημαντικό αναδυόμενο λοιμώδες νόσημα που εκδηλώνεται κυρίως με πυρετό, μυϊκό τρόμο, κεφαλαλγία και μυαλγία. Οι περισσότεροι ασθενείς εκτέθηκαν σε κρότωνες 1-2 εβδομάδες πριν από την εμφάνιση των συμπτωμάτων. Η προχωρημένη ηλικία και οι συνυπάρχουσες λοιμώξεις, αυξάνουν τη βαρύ- τητα της νόσου. Οι μισοί περίπου ασθενείς χρειάζονται νοσηλεία, ενώ σε ένα ποσοστό 17% από αυτούς απαιτείται νοσηλεία σε εντατική μονάδα. Αν και η θνησιμότητα είναι μικρή (0.5-1%), ενδέχεται να εμφανιστούν σημαντικές επιπλοκές της νόσου, όπως είναι η αναπνευστική ανεπάρκεια, οι ευκαιριακές λοιμώξεις από ιούς ή μύκητες, η ραβδομυόλυση, η οξεία νεφρική ανεπάρκεια και η απομυελινωτική πολυνευροπάθεια.56 Στις Η.Π.Α αναφέρονται περισσότερα από 700 περιστατικά κάθε χρόνο,6 ενώ στην Ευρώπη έχει διαπιστωθεί σε μικρό αριθμό ασθενών στην Αυστρία, την Ισπανία, την Ιταλία, τη Λεττονία, τη Νορβηγία, την Ολλανδία, την Πολωνία, και τη Σουηδία.56 Στην Ελλάδα, το 20% των υγιών αιμοδοτών βρέθηκε να είναι οροθετικό στο Α. phagocytophilum, ενώ, έξι, επιβεβαιωμένα με μοριακές μεθόδους, περιστατικά αναφέρθηκαν πρόσφατα στη Κρήτη.57,58
> Βιβλιογραφία
1. Lillini E, Macri G, Proietti G, Scarpulla M. New findings on anaplasmosis caused by infection with Anaplasma phagocytophilum. Ann N Y Acad Sci 2006, 1081: 360-370.
2. Woldehiwet Z. The natural history of Anaplasma phagocytophilum. Vet Parasitol 2010, 167: 108-122.
3. Dumler JS, Barbet AF, Bekker CP, Dasch GA, Palmer GH, Ray SC, Rikihisa Y, Rurangirwa FR. Reorganization of genera in the families Rickettsiaceae and Anaplasmataceae in the order Rickettsiales: unification of some species of Ehrlichia with Anaplasma, Cowdria with Ehrlichia and Ehrlichia with Neorickettsia, descriptions of six new species combinations and designation of Ehrlichia equi and ‘HGE agent’ as subjective synonyms of Ehrlichia phagocytophila. Int J Syst Evol Microbiol 2001, 51: 2145-2165.
4. Pusterla N, Pusterla JB, Braun U, Lutz H. Experimental cross-infections with Ehrlichia phagocytophila and human granulocytic ehrlichia-like agent in cows and horses. Vet Rec 1999, 145: 311-314.
5. Blanco JR, Oteo JA. Human granulocytic ehrlichiosis in Europe. Clin Microbiol Infect 2002, 8: 763-772.
6. Diniz PP, Breitschwerdt EB. Anaplasma phagocytophilum infection (Canine granulocytotropic anaplasmosis). In: Infectious diseases of the dog and cat. Greene CE (ed). 4th edn. Elsevier/Saunders: St. Luis, Missouri, 2012, pp. 244-254.
7. Carrade DD, Foley JE, Borjesson DL, Sykes JE. Canine granulocytic anaplasmosis: a review. J Vet Intern Med 2009, 23: 1129-1141.
8. Alberti A, Addis MF, Sparagano O, Zobba R, Chessa B, Cubeddu T, Parpaglia ML, Ardu M Pittau M. Anaplasma phagocytophilum, Sardinia, Italy. Emerg Infect Dis 2005, 11: 1322-1324.
9. Ogden NH, Bown K, Horrocks BK, Woldehiwet Z, Bennett M. Granulocytic Ehrlichia infection in ixodid ticks and mammals in woodlands and uplands of the U.K. Med Vet Entomol 1998, 12: 423-429.
10. Leschnik M, Kirtz G, Viranyi Z, Wille-Piazzai W, Duscher G. Acute granulocytic anaplasmosis in a captive timber wolf (Canis lupus occidentalis). J Zoo Wildl Med 2012, 43: 645-648.
11. Stuen S. Anaplasma phagocytophilum - the most widespread tick-borne infection in animals in Europe. Vet Res Commun 2007, 31Suppl 1: 79-84.
12. Bakken JS, Dumler S. Human granulocytic anaplasmosis. Infect Dis Clin North Am 2008, 22: 433-448.
13. Bjoersdorff A, Bergstrom S, Massung RF, Haemig PD, Olsen B. Ehrlichia-infected ticks on migrating birds. Emerg Infect Dis 2001, 7: 877-879.
14. Palomar AM, Santibanez P, Mazuelas D, Roncero L, Santibanez S, Portillo A, Oteo JA. Role of birds in dispersal of etiologic agents of tick-borne zoonoses, Spain, 2009. Emerg Infect Dis 2012, 18: 1188-1191.
15. Hildebrandt A, Franke J, Meier F, Sachse S, Dorn W, Straube E. The potential role of migratory birds in transmission cycles of Babesia spp., Anaplasma phagocytophilum, and Rickettsia spp. Ticks Tick Borne Dis 2010, 1: 105-107.
16. Little SE. Ehrlichiosis and anaplasmosis in dogs and cats. Vet Clin North Am Small Anim Pract 2010, 40: 1121-1140.
17. Pusterla N, Braun U, Wolfensberger C, Lutz H. Intrauterine infection with Ehrlichia phagocytophila in a cow. Vet Rec 1997, 141: 101-102.
18. Pusterla N, Huder J, Wolfensberger C, Braun U, Lutz H. Laboratory findings in cows after experimental infection with Ehrlichia phagocytophila. Clin Diagn Lab Immunol 1997, 4: 643- 647.
19. Plier ML, Breitschwerdt EB, Hegarty BC, Kidd LB. Lack of evidence for perinatal transmission of canine granulocytic anaplasmosis from a bitch to her offspring. J Am Anim Hosp Assoc 2009, 45: 232-238.
20. Stadtbaumer K, Leschnik MW, Nell B. Tick-borne encephalitis virus as a possible cause of optic neuritis in a dog. Vet Ophthalmol 2004, 7: 271-277.
21. Domingos MC, Trotta M, Briend-Marchal A, Medaille C. Anaplasmosis in two dogs in France and molecular and phylogenetic characterization of Anaplasma phagocytophilum. Vet Clin Pathol 2011, 40: 215-221.
22. Kohn B, Silaghi C, Galke D, Arndt G, Pfister K. Infections with Anaplasma phagocytophilum in dogs in Germany. Res Vet Sci 2011, 91: 71-76.
23. Pusterla N, Pusterla JB, Deplazes P, Wolfensberger C, Muller W, Horauf A, Reusch C, Lutz H. Seroprevalence of Ehrlichia canis and of canine granulocy.tic Ehrlichia infection in dogs in Switzerland. J Clin Microbiol 1998, 36: 3460-3462.
24. Shaw SE, Binns SH, Birtles RJ, Day MJ, Smithson R, Kenny MJ. Molecular evidence of tick-transmitted infections in dogs and cats in the United Kingdom. Vet Rec 2005, 157: 645-648.
25. Tabar MD, Francino O, Altet L, Sanchez A, Ferrer L, Roura X. PCR survey of vectorborne pathogens in dogs living in and around Barcelona, an area endemic for leishmaniasis. Vet Rec 2009, 164: 112-116.
26. Manna L, Alberti A, Pavone LM, Scibelli A, Staiano N, Gravino AE. First molecular characterization of a granulocytic Ehrlichia strain isolated from a dog in South Italy. Vet J 2004, 167: 224-227.
27. Gravino AE, De Caprariis D, Manna L, Cerundolo R, Sagazio P, Buonavoglia C. Preliminary report of infection in dogs related to Ehrlichia equi: description of three cases. New Microbiol 1997, 20: 361-363.
28. Skotarczak B, Adamska M, Rymaszewska A, Supron M, Sawczuk M, Maciejewska A. [Anaplasma phagocytophila and protozoans of Babesia genus in dogs from endemic areas of Lyme disease in north-western Poland]. Wiad Parazytol 2004, 50: 555-561.
29. Santos AS, Alexandre N, Sousa R, Nuncio MS, Bacellar F, Dumler JS. Serological and molecular survey of Anaplasma species infection in dogs with suspected tickborne disease in Portugal. Vet Rec 2009, 164: 168-171.
30. Majlathova V, Majlath I, Vichova B, Gul’ova I, Derdakova M, Sesztakova E, Pet’ko B. Polymerase chain reaction confirmation of Babesia canis canis and Anaplasma phagocytophilum in dogs suspected of babesiosis in Slovakia. Vector Borne Zoonotic Dis 2011, 11: 1447-1451.
31. Tozon N, Petrovec M, Avsic-Zupanc T. Clinical and laboratory features of the first detected cases of A. phagocytophila infections in dogs from Slovenia. Ann N Y Acad Sci 2003, 990: 424-428.
32. Ravnik U, Tozon N, Smrdel KS, Zupanc TA. Anaplasmosis in dogs: the relation of haematological, biochemical and clinical alterations to antibody titre and PCR confirmed infection. Vet Microbiol 2011, 149: 172-176.
33. Johansson KE, Pettersson B, Uhlen M, Gunnarsson A, Malmqvist M, Olsson E. Identification of the causative agent of granulocytic ehrlichiosis in Swedish dogs and horses by direct solid phase sequencing of PCR products from the 16S rRNA gene. Res Vet Sci 1995, 58: 109-112.
34. Egenvall AE, Hedhammar AA, Bjoersdorff AI. Clinical features and serology of 14 dogs affected by granulocytic ehrlichiosis in Sweden. Vet Rec 1997, 140: 222-226.
35. Mylonakis ME, Koutinas AF, Baneth G, Polizopoulou Z, Fytianou A. Mixed Ehrlichia canis, Hepatozoon canis, and presumptive Anaplasma phagocytophilum infection in a dog. Vet Clin Pathol 2004, 33: 249-251.
36. Mylonakis ME, Koutinas AF, Breitschwerdt EB, Hegarty BC, Billinis CD, Leontides LS, Kontos VS. Chronic canine ehrlichiosis (Ehrlichia canis): a retrospective study of 19 natural cases. J Am Anim Hosp Assoc 2004, 40: 174-184.
37. Giadinis ND, Chochlakis D, Ioannou I, Kritsepi-Konstantinou M, Papadopoulos E, Psaroulaki A, Karatzias H. Haemorrhagic diathesis in a ram with Anaplasma phagocytophilum infection. J Comp Pathol 2011, 144: 82-85.
38. Kachrimanidou M, Papa A, Chochlakis D, Pavlidou V, Psaroulaki A. Molecular evidence for Anaplasma phagocytophilum in Ixodes ricinus ticks from Greece. Vector Borne Zoonotic Dis 2011, 11: 1391-1393.
39. Kohn B, Galke D, Beelitz P, Pfister K. Clinical features of canine granulocytic anaplasmosis in 18 naturally infected dogs. J Vet Intern Med 2008, 22: 1289-1295.
40. Egenvall A, Bonnett BN, Gunnarsson A, Hedhammar A, Shoukri M, Bornstein S, Artursson K. Sero-prevalence of granulocytic Ehrlichia spp. and Borrelia burgdorferi sensu lato in Swedish dogs 1991-94. Scand J Infect Dis 2000, 32: 19-25.
41. Greig B, Asanovich KM, Armstrong PJ, Dumler JS. Geographic, clinical, serologic, and molecular evidence of granulocytic ehrlichiosis, a likely zoonotic disease, in Minnesota and Wisconsin dogs. J Clin Microbiol 1996, 34: 44-48.
42. Poitout FM, Shinozaki JK, Stockwell PJ, Holland CJ, Shukla SK. Genetic variants of Anaplasma phagocytophilum infecting dogs in Western Washington State. J Clin Microbiol 2005, 43: 796-801.
43. Smith FD, Ballantyne R, Morgan ER, Wall R. Estimating Lyme disease risk using pet dogs as sentinels. Comp Immunol Microbiol Infect Dis 2012, 35: 163-167.
44. Savic S, Vidic B, Lazic S, Lako B, Potkonjak A, Lepsanovic Z. Borrelia burgdorferi in ticks and dogs in the province of Vojvodina, Serbia. Parasite 2010, 17: 357-361.
45. Pantchev N, Schaper R, Limousin S, Norden N, Weise M, Lorentzen L. Occurrence of Dirofilaria immitis and tick-borne infections caused by Anaplasma phagocytophilum, Borrelia burgdorferi sensu lato and Ehrlichia canis in domestic dogs in France: results of a countrywide serologic survey. Parasitol Res 2009, 105 Suppl 1: S101-114.
46. Rymaszewska A, Adamska M. Molecular evidence of vector-borne pathogens coinfecting dogs from Poland. Acta Vet Hung 2011, 59: 215-223.
47. Eberts MD, Vissotto de Paiva Diniz PP, Beall MJ, Stillman BA, Chandrashekar R, Breitschwerdt EB. Typical and atypical manifestations of Anaplasma phagocytophilum infection in dogs. J Am Anim Hosp Assoc 2011, 47: 86-94.
48. Granick JL, Armstrong PJ, Bender JB. Anaplasma phagocytophilum infection in dogs: 34 cases (2000-2007). J Am Vet Med Assoc 2009, 234: 1559-1565.
49. Cockwill KR, Taylor SM, Snead EC, Dickinson R, Cosford K, Malek S, Lindsay LR, Diniz PP. Granulocytic anaplasmosis in three dogs from Saskatoon, Saskatchewan. Can Vet J 2009, 50: 835- 840.
50. Foley J, Drazenovich N, Leutenegger CM, Chomel BB. Association between polyarthritis and thrombocytopenia and increased prevalence of vectorborne pathogens in Californian dogs. Vet Rec 2007, 160: 159-162.
51. Kirtz G, Meli M, Leidinger E, Ludwig P, Thum D, Czettel B, Kolbl S, Lutz H. Anaplasma phagocytophilum infection in a dog: identifying the causative agent using PCR. J Small Anim Pract 2005, 46: 300-303.
52. Pusterla N, Huder J, Wolfensberger C, Litschi B, Parvis A, Lutz H. Granulocytic ehrlichiosis in two dogs in Switzerland. J Clin Microbiol 1997, 35: 2307-2309.
53. Chandrashekar R, Mainville CA, Beall MJ, O’Connor T, Eberts MD, Alleman AR, Gaunt SD, Breitschwerdt EB. Performance of a commercially available in-clinic ELISA for the detection of antibodies against Anaplasma phagocytophilum, Ehrlichia canis, and Borrelia burgdorferi and Dirofilaria immitis antigen in dogs. Am J Vet Res 2010, 71: 1443-1450.
54. Mylonakis ME, Koutinas AF, Theodorou K, Siarkou VI, Kontos VI. Clinical relevance of serologic testing in canine monocytic ehrlichiosis (Ehrlichia canis). Hellenic Vet Med Soc 2012, 63: 127- 134.
55. McCall JW, Baker CF, Mather TN, Chester ST, McCall SD, Irwin JP, Young SL, Cramer LG, Pollmeier MG. The ability of a topical novel combination of fipronil, amitraz and (S)-methoprene to protect dogs from Borrelia burgdorferi and Anaplasma phagocytophilum infections transmitted by Ixodes scapularis. Vet Parasitol 2011, 179: 335-342.
56. Bakken JS, Dumler JS. Clinical diagnosis and treatment of human granulocytotropic anaplasmosis. Ann N Y Acad Sci 2006, 1078: 236-247.
57. Chochlakis D, Psaroulaki A, Kokkini S, Kostanatis S, Arkalati E, Karagrannaki E, Tsiatis K, Tselentis Y, Gikas A. First evidence of Anaplasma infection in Crete, Greece. Report of six human cases. Clin Microbiol Infect 2009, 15 Suppl 2: 8-9.
58. Chochlakis D, Papaeustathiou A, Minadakis G, Psaroulaki A, Tselentis Y. A serosurvey of Anaplasma phagocytophilum in blood donors in Crete, Greece. Eur J Clin Microbiol Infect Dis 2008, 27: 473-475.




