> Περίληψη
Οι τοξικώσεις από φάρμακα είναι αρκετά συχνές στο σκύλο και τη γάτα και διακρίνονται σε εκείνες που οφείλονται στη φαρμακολογική ή την εγγενή τοξική δράση της υπεύθυνης ουσίας (τύπου Α ή προβλέψιμες) και σε εκείνες που δεν απορρέουν από αυτή (τύπου Β ή απρόβλεπτες). Η εμφάνιση των τοξικώσεων τύπου Α εξαρτάται από πλήθος παραγόντων που σχετίζονται με το ασθενές ζώο, το δοσολογικό σχήμα και την ταυτόχρονη χορήγηση άλλων φαρμάκων. Συχνότερα εκδηλώνονται με συμπτώματα από τα όργανα εκείνα στα οποία συσσωρεύεται το υπεύθυνο φάρμακο ή από εκείνα που έχουν αυξημένο μεταβολικό ρυθμό. Αντίθετα στις τοξικώσεις τύπου Β συχνότερα προσβάλλονται όργανα που διαθέτουν τις απαραίτητες πρωτεΐνες οι οποίες, αφού συνδεθούν με τη φαρμακευτική ουσία ή τους μεταβολίτες της (απτένια), σχηματίζουν πλήρη αντιγόνα ή όργανα όπου δεσμεύονται τα κυκλοφορούντα ανοσοσύμπλοκα. Τα φάρμακα που συχνότερα ευθύνονται για την εμφάνιση τοξικώσεων στο σκύλο και τη γάτα είναι τα αμινογλυκοσιδικά αντιμικροβιακά, οι μακροκυκλικές λακτόνες (αβερμεκτίνες και μιλμπεμυκίνες), τα πυρεθρινοειδή, τα μη στεροειδή αντιφλεγμονώδη, η φαινοβαρβιτάλη και η διαζεπάμη.
> Εισαγωγή
Οι τοξικώσεις του σκύλου και της γάτας ύστερα από χορήγηση ή κατά λάθος έκθεση σε διάφορα φάρμακα είναι αρκετά συχνές στην κλινική πράξη. Στις Η.Π.Α. η συχνότερη κατηγορία τοξικώσεων κατά τη χρονική περίοδο 2002-2010 ήταν εκείνες που οφείλονται σε φάρμακα για ανθρώπινη χρήση (περίπου 25% στο σύνολο των περιστατικών), ενώ παράλληλα οι τοξικώσεις από εξωπαρασιτοκτόνα και διάφορα άλλα κτηνιατρικά φάρμακα συμπεριλαμβάνονταν στις 10 συχνότερες κατηγορίες.1
Σκοπός της εργασίας αυτής είναι να παρουσιαστούν τα σύγχρονα δεδομένα πάνω στην ταξινόμηση και τους μηχανισμούς που ευθύνονται για τις φαρμακευτικές τοξικώσεις στο σκύλο και τη γάτα και στη συνέχεια να γίνει αναφορά στις συχνότερα υπεύθυνες δραστικές ουσίες ή ομάδες δραστικών ουσιών. Οι οδηγίες για την αντιμετώπιση των περιστατικών αυτών περιορίζονται στα ειδικά κατά περίπτωση θεραπευτικά μέτρα χωρίς να γίνεται ιδιαίτερη αναφορά στα γενικά μέτρα αντιμετώπισης των τοξικώσεων (αρχική σταθεροποίηση του ζώου, αποτοξίκωση, υποστηρικτική και συμπτωματική αγωγή). Επιπλέον, δε γίνεται αναφορά στις φαρμακευτικές δερματίτιδες που εκδηλώνονται ως επείγοντα περιστατικά (αγγειογενές οίδημα, σύνδρομο Stevens-Johnson και τοξική επιδερμική νεκρόλυση, αγγειίτιδα, άσηπτη φλυκταινώδης ερυθροδερμία, σύνδρομο υπερευαισθησίας στις σουλφοναμίδες, άσηπτη ουδετεροφιλική δερμάτωση).2
> Ταξινόμηση και μηχανισμοί των τοξικώσεων από φάρμακα στο σκύλο και τη γάτα
Οι τοξικώσεις από φάρμακα διακρίνονται σε εκείνες που οφείλονται στη φαρμακολογική ή εγγενή τοξική δράση της υπεύθυνης ουσίας και συνήθως εξαρτώνται από τη συγκέντρωσή της στο αίμα και τους ιστούς (τύπου Α ή προβλέψιμες) και σε εκείνες που δεν εξαρτώνται από τη συγκέντρωση, εμφανίζονται σε μικρό ποσοστό των υπό θεραπεία ζώων και συχνότερα είναι ανοσολογικής αιτιολογίας (τύπου Β ή απρόβλεπτες).3,4 Τα όργανα που προσβάλλονται σε τοξικώσεις τύπου Α διαφέρουν ανάλογα με το υπεύθυνο φάρμακο, συχνότερα όμως προσβάλλονται εκείνα όπου αυτό συσσωρεύεται, μεταβολίζεται και απεκκρίνεται (π.χ. ήπαρ, νεφροί) ή εκείνα που έχουν αυξημένο μεταβολικό ρυθμό (π.χ. μυελός των οστών, εντερικός βλεννογόνος).3 Αντίθετα οι τοξικώσεις τύπου Β εκδηλώνονται συχνότερα σε όργανα όπου υπάρχουν οι κατάλληλες πρωτεΐνες οι οποίες, αφού συνδεθούν με τη φαρμακευτική ουσία ή τους μεταβολίτες της (απτένια), σχηματίζουν πλήρες αντιγόνο (π.χ. στο δέρμα) ή σε εκείνα στα οποία δεσμεύονται τα κυκλοφορούντα ανοσοσύμπλοκα (π.χ. τα νεφρικά σπειράματα, οι αρθρώσεις, τα αγγεία).3
Η εμφάνιση των τοξικώσεων τύπου Α εξαρτάται από ποικίλους παράγοντες, οι κυριότεροι από τους οποίους είναι: α) το ζωικό είδος (π.χ. η σχετική έλλειψη γλυκουρονικής τρανσφεράσης στη γάτα έχει ως αποτέλεσμα την αυξημένη ευαισθησία στην τοξίκωση από παρακεταμόλη), β) το ίδιο το ζώο και οι ιδιαιτερότητές του που επηρεάζουν τη φαρμακοκινητική διαφόρων ουσιών, όπως η μετάλλαξη του γονιδίου που συνθέτει τη γλυκοπρωτεΐνη-P (P-gp) και είναι υπεύθυνη για την τοξίκωση από ιβερμεκτίνη σε σκύλους της φυλής Collie, γ) οι τυχόν προϋπάρχουσες αλλοιώσεις των οργάνων όπου η υπεύθυνη ουσία ασκεί την τοξική της δράση (όργανα «στόχος») και η λειτουργική επάρκεια των οργάνων, όπως το ήπαρ και οι νεφροί, που είναι υπεύθυνα για το μεταβολισμό και την απέκκριση της δραστικής ουσίας, δ) η επίδραση που έχει στα τελευταία αλλά και στα όργανα «στόχος» το νόσημα ή η παθολογική κατάσταση για την αντιμετώπιση του οποίου χορηγείται το υπεύθυνο για την τοξίκωση φάρμακο, ε) η δραστική ουσία και ιδιαίτερα ο θεραπευτικός της δείκτης, δηλαδή η διαφορά μεταξύ της θεραπευτικής και της τοξικής της δόσης, στ) το δοσολογικό σχήμα (δόση, συχνότητα, οδός και διάρκεια χορήγησης), όπως στην περίπτωση των αμινογλυκοσιδικών αντιμικροβιακών όπου η χορήγηση της ίδιας συνολικής ημερήσιας δόσης διαιρεμένης σε δύο ή τρεις ισόποσες δόσεις αυξάνει την πιθανότητα τοξίκωσης, και ζ) η ταυτόχρονη χορήγηση άλλων φαρμάκων που μεταβάλλουν τη φαρμακοκινητική του τοξικού φαρμάκου αλληλεπιδρώντας στην P-gp και τα ένζυμα του κυτοχρώματος P450 ή προκαλούν αύξηση της συγκέντρωσής του στα όργανα «στόχος».3,4

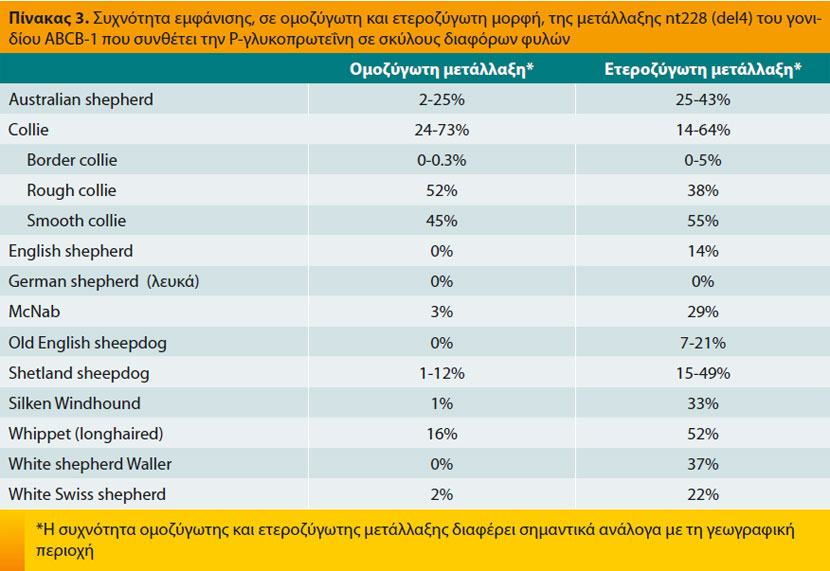
H P-gp συντίθεται από το γονίδιο ABCB-1(ή MDR1) και εντοπίζεται στη μεμβράνη πολλών κυττάρων, όπως εκείνων του εντερικού βλεννογόνου, τα ενδοθηλιακά κύτταρα του κεντρικού νευρικού συ- στήματος που αποτελούν μέρος του αιματοεγκεφαλικού φραγμού, τα ηπατοκύτταρα και τα επιθηλιακά κύτταρα των νεφρικών σωληναρίων.4-6 Ο βασικός βιολογικός της ρόλος είναι να μειώνει την ενδοκυτταρική συγκέντρωση διαφόρων ουσιών μεταξύ των οποίων και τα φάρμακα εκείνα (Πίνακας 1) που είναι υποστρώματα της P-gp.4,6,7 Η δραστηριότητά της αυξάνει ύστερα από τη χορήγηση ορισμένων φαρμακευτικών ουσιών (Πίνακας 2) γεγονός που έχει ως αποτέλεσμα τη μειωμένη απορρόφηση από το έντερο και κατά συνέπεια τη μειωμένη θεραπευτική δράση των υποστρωμάτων της, όταν βέβαια τα τελευταία χορηγούνται από το στόμα.4 Ακριβώς το αντίθετο συμβαίνει σε περίπτωση ταυτόχρονης χορήγησης φαρμάκων που μειώνουν τη δραστηριότητατης P-gp (Πίνακας 2) ή μεταλλάξεων του γονιδίου ABCB-1, όπως η μετάλλαξη nt228 (del4) σε σκύλους διαφόρων φυλών (Πίνακας 3) μεταξύ των οποίων τα Collie.4,6,8-13 Στις περιπτώσεις αυτές αυξάνει η πιθανότητα τοξίκωσης από τα υποστρώματα της P-gp, όπως οι μακροκυκλικές λακτόνες, η λοπεραμίδη και τα αντινεοπλασματικά φάρμακα, λόγω της αυξημένης απορρόφησής τους από το έντερο, της αδυναμίας απομάκρυνσής τους από το κεντρικό νευρικό σύστημα και ενδεχομένως της μειωμένης απέκκρισής τους με τη χολή και τα ούρα.4,6,14-16 Επισημαίνεται ότι ένας σκύλος μπορεί να είναι ομοζύγωτος ή ετεροζύγωτος για τη μετάλλαξη nt228 (del4) και ότι η πιθανότητα τοξίκωσης από την ίδια δόση του υπεύθυνου φαρμάκου είναι μεγαλύτερη στην πρώτη περίπτωση, χωρίς όμως να αποκλείεται στη δεύτερη, γεγονός που επιβάλλει την αποφυγή χορήγησης ή τη μείωση της δόσης των υποστρωμάτων της P-gp και στις δύο περιπτώσεις.4,8,16 Επιπλέον, ανεξάρτητα από τη φυλή του ζώου, πρέπει να αποφεύγεται η ταυτόχρονη χορήγηση φαρμάκων που μειώνουν τη δράση της P-gp αλλά και φαρμάκων που είναι υποστρώματά της, ιδιαίτερα μάλιστα όταν τα τελευταία χαρακτηρίζονται από μικρό θεραπευτικό δείκτη.3, 6

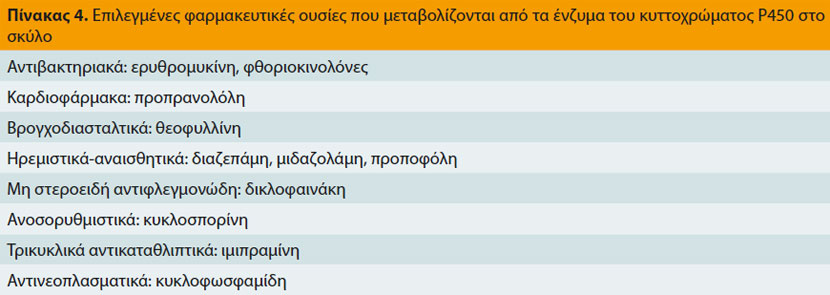
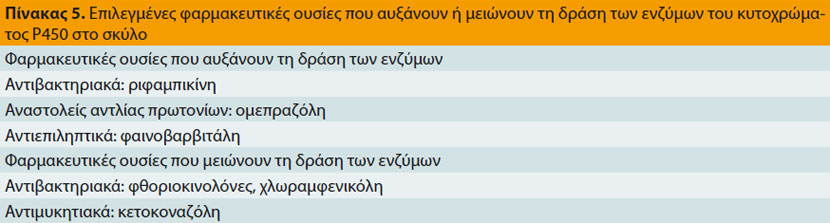
Τα ένζυμα του κυτοχρώματος P450, που είναι υπεύθυνα για το μεταβολισμό ορμονών, φαρμάκων και διάφορων άλλων χημικών ουσιών, βρίσκονται σε πολλά όργανα και ιστούς, μεταξύ των οποίων το έντερο και το ήπαρ.17 Στο έντερο μεταβολίζουν φάρμακα που χορηγούνται από το στόμα μειώνοντας έτσι τη βιοδιαθεσιμότητά τους,4 ενώ στο ήπαρ, καταλύουν πλήθος βιοχημικών αντιδράσεων που σχετίζονται με το μεταβολισμό των φαρμάκων και που έχουν ως αποτέλεσμα το σχηματισμό ανενεργών ή ενεργών μεταβολιτών ή τοξικών παραγώγων (Πίνακας 4).17,18 Η δραστηριότητα ορισμένων ενζύμων του κυτοχρώματος P450 που είναι υπεύθυνα για το μεταβολισμό συγκεκριμένων φαρμάκων (π.χ. τα ένζυμα CYP2B11, CYP2D15) έχει διαπιστωθεί ότι διαφέρει σημαντικά μεταξύ σκύλων που ανήκουν στην ίδια ή σε διαφορετική φυλή.4,18,19 Επιπλέον, η ταυτόχρονη χορήγηση άλλων φαρμακευτικών ουσιών που αναστέλλουν τα ένζυμα αυτά (Πίνακας 5) έχει σαν αποτέλεσμα το μειωμένο μεταβολισμό, τη συσσώρευση και την αυξημένη πιθανότητα τοξίκωσης από τα φάρμακα εκείνα που εξαρτώνται από τα ένζυμα του κυτοχρώματος P-450 για το μεταβολισμό τους.7,17,20-22 Τέλος, οι αλληλεπιδράσεις των φαρμάκων στην δραστηριότητα των ενζύμων αυτών μπορούν να χρησιμοποιηθούν για τη μείωση της δόσης και κατά συνέπεια του κόστους της θεραπείας, όπως στην περίπτωση της κυκλοσπορίνης, η δόση της οποίας μπορεί να μειωθεί μέχρι και 75% όταν χορηγείται ταυτόχρονα με την κετοκοναζόλη.7,23,24
> Τοξίκωση από αμινογλυκοσιδικά αντιμικροβιακά στο σκύλο και τη γάτα
Τα αμινογλυκοσιδικά αντιμικροβιακά (π.χ. αμινοσιδίνη, αμικασίνη, γενταμικίνη, καναμυκίνη, νεομυκίνη, στρεπτομυκίνη, τομπραμυκίνη) είναι δρα- στικά κυρίως κατά των αερόβιων αρνητικών κατά Gram βακτηρίων (π.χ. Pseudomonassp.), αλλά και κατά ορισμένων θετικών κατά Gram (Staphylococcus sp.), όπως και κατά της Leishmaniasp., προκειμένου για την αμινοσιδίνη.25 Η βακτηριοκτόνος δράση τους επιτυγχάνεται ύστερα από τη συσσώρευσή τους στο κυτταρόπλασμα και τη σύνδεσή τους με την υπομονάδα 30S των ριβοσωματίων, που έχει ως αποτέλεσμα τη διαταραχή της σύνθεσης των πρωτεϊνών, την αυξημένη διαπερατότητα της κυτταρικής τους μεμβράνης και τελικά το θάνατο των μικροοργανισμών.25 Η βακτηριοκτόνος, η μετά το αντιμικροβιακό δράση (postantibiotic effect-PAE) και η αποφυγή ανάπτυξης ανθεκτικών βακτηρίων εξαρτώνται από τη μέγιστη συγκέντρωση που επιτυγχάνουν και όχι από τη μεταξύ των διαδοχικών δόσεων χρονική περίοδο στη διάρκεια της οποίας η συγκέντρωσή τους παραμένει μεγαλύτερη από την ελάχιστη συγκέντρωση αναστολής των κάθε φορά υπεύθυνων μικροοργανισμών.25 Για το λόγο αυτό, τα αμινογλυκοσιδικά αντιμικροβιακά πρέπει να χορηγούνται σε μια ημερήσια δόση και όχι κάθε 8 ή 12 ώρες όπως γινόταν παλαιότερα.25,26 Μέχρι και πριν από λίγα χρόνια οι ουσίες αυτές, κυρίως λόγω της τοξικότητάς τους, είχαν αντικατασταθεί σε μεγάλο βαθμό από τις φθοριοκινολόνες και χρησιμοποιούνταν σχεδόν αποκλειστικά σε περιστατικά σηψαιμίας.25 Όμως η χρήση των αμινογλυκοσιδικών αντιμικροβιακών έχει διευρυνθεί τον τελευταίο καιρό και ενδέχεται να αυξηθεί ακόμα περισσότερο τα επόμενα χρόνια, τόσο για τη θεραπεία της λεϊσμανίωσης του σκύλου (αμινοσιδίνη), όσο και των λοιμώξεων από ανθεκτικό στη μεθικιλλίνη S. pseudintermedius (συχνότερα η αμικασίνη).27
Η τοξίκωση από τα αμινογλυκοσιδικά αντιμικροβιακά στο σκύλο και τη γάτα είναι τύπου Α και αφορά κυρίως στους νεφρούς και το έσω ους, επηρεάζοντας τόσο την ακοή όσο και την ισορροπία και σπανιότερα τις νευρομυϊκές συνάψεις.3,25 Η νεφροτοξίκωση οφείλεται στην απέκκριση των ουσιών αυτών μέσω των νεφρών, με αποτέλεσμα να συσσωρεύονται στα επιθηλιακά κύτταρα των νεφρικών σωληναρίων τα οποία και νεκρώνονται και στην αναστολή της δράσης της φωσφολιπάσης που είναι απαραίτητη για τη σύνθεση των προσταγλαδινών, με τελικό αποτέλεσμα την αγγειοσύσπαση και το μειωμένο ρυθμό σπειραματικής διήθησης.3,25 Οι παράγοντες που αυξάνουν την πιθανότητα νεφροτοξίκωσης είναι πολλοί και περιλαμβάνουν τη δραστική ουσία (η γενταμικίνη θεωρείται περισσότερο νεφροτοξική σε σχέση με την αμικασίνη), τη χορήγηση κάθε 8 ή 12 ώρες αντί για κάθε 24 ώρες, την παρατεταμένη διάρκεια της θεραπείας, τις προϋπάρχουσες αλλοιώσεις των νεφρών, τη μειωμένη ροή αίματος στους νεφρούς, τη συνυπάρχουσα οξέωση και τις ηλεκτρολυτικές διαταραχές (υποκαλιαιμία, υπονατριαιμία) και την ταυτόχρονη χορήγηση άλλων νεφροτοξικών φαρμάκων ή της φουροσεμίδης.25,27 Ο πλέον αξιόπιστος πρώιμος δείκτης νεφρικής βλάβης είναι η αυξημένη δραστηριότητα στα ούρα των ενζύμων εκείνων που απελευθερώνονται ύστερα από τη νέκρωση των επιθηλιακών κυττάρων των ουροφόρων σωληναρίων, όπως είναι η γ-γλουταμυλική τρανσφεράση (γ-GT), η Ν-ακέτυλο-β-γλυκοσαμινιδάση (NAG), η αλανινο-αμινοτρανσφεράση (ALT) και η αλκαλική φωσφατάση (ALP),3,25,27,28 ενώ σε πιο προχωρημένο στάδιο διαπιστώνεται κυλινδρουρία, μειωμένο ειδικό βάρος, πρωτεϊνουρία, γλυκοζουρία και τελικά αζωθαιμία.3,25,26
Η θεραπευτική αντιμετώπιση, εκτός από τη διακοπή χορήγησης του φαρμάκου, ταυτίζεται με εκείνη της οξείας νεφρικής ανεπάρκειας με τη διαφορά ότι σε περίπτωση που διαπιστωθεί ολιγουρία αντενδείκνυται η χορήγηση φουροσεμίδης, καθώς αυτή αυξάνει τη συγκέντρωση των αμινογλυκοσικών αντιμικροβιακών στα επιθηλιακά κύτταρα των ουροφόρων σηλωναρίων.3 Η πρόληψη της νεφροτοξίκωσης περιλαμβάνει την αποφυγή όλων των παραγόντων που αυξάνουν την πιθανότητά της και ιδανικά την εξατομίκευση του δοσολογικού σχήματος με βάση τη συγκέντρωση της δραστικής ουσίας στον ορό του αίματος αμέσως πριν την επόμενη χορήγηση (π.χ. στην περίπτωση της αμικασίνης αυτή πρέπει να είναι μικρότερη από 6μg/ml).3,27,29 Δυστυχώς όμως το τελευταίο δεν είναι εύκολα εφαρμόσιμο στην κλινική πράξη. Για το λόγο αυτό, προτείνεται ο έλεγχος των ασθενών ζώων για το ενδεχόμενο αφυδάτωσης, η ανάλυση των ούρων (με ιδιαίτερη έμφαση στη μέτρηση του λόγου πρωτεϊνών/κρεατινίνης, στη μέτρηση της δραστηριότητας των ενζύμων στα ούρα και στη μικροσκοπική εξέταση του ιζήματος για κυλινδρουρία) και ο βιοχημικός έλεγχος της απεκκριτικής ικανότητας των νεφρών (συγκέντρωση αζώτου ουρίας, κρεατινίνης και ανόργανου φωσφόρου στο αίμα) κάθε 7 ημέρες καθ’ όλη τη διάρκεια της θεραπείας και για μια εβδομάδα μετά τη διακοπή της.3,27 Επιπλέον, η ταυτόχρονη χορήγηση ουσιών με αντιοξειδωτική δράση, όπως είναι η σιλυμαρίνη [20mg/kg σωματικού βάρους (Σ.Β.) ημερησίως, από το στόμα] και η βιταμίνη Ε (25mg/kg Σ.Β. ημερησίως, από το στόμα) ενδέχεται να μειώσει την τοξική επίδραση των αντιμικροβιακών αυτών στους νεφρούς.30
Η ωτοτοξική δράση, που συνήθως δεν είναι αναστρέψιμη και είναι μεγαλύτερη για τη στρεπτομυκίνη σε σχέση με τα υπόλοιπα φάρμακα της ομάδας αυτής, οφείλεται στην επί μακρό παραμονή τους στην περιλέμφο και τις μεταβολικές διαταραχές που αυτό συνεπάγεται, κυριότερη από τις οποίες φαίνεται να είναι η οξειδωτική βλάβη από τις ελεύθερες ρίζες οξυγόνου.3,25,31 Μπορεί να εμφανιστεί μετά από συστηματική ή τοπική χορήγηση και να εκδηλωθεί με κώφωση ή με περιφερικό αιθουσαίο σύνδρομο ή και με τα δύο, γεγονός που εξαρτάται επίσης από τη δραστική ουσία (π.χ. η αμικασίνη και η καναμυκίνη έχουν αυξημένη τοξικότητα για το όργανο της ακοής, ενώ η στρεπτομυκίνη και η γενταμικίνη για το όργανο της ισορροπίας).25,31 Η πιθανότητα ωτοτοξίκωσης εξαρτάται, εκτός από τη δραστική ουσία, από τη συχνότητα χορήγησης, τη διάρκεια της θεραπείας και την ταυτόχρονη χορήγηση άλλων ωτοτοξικών φαρμάκων.
Η διάγνωση στηρίζεται στην ακουομετρία (κώφωση) που δεν είναι ευρέως διαδεδομένη στην κλινική πράξη αλλά σήμερα στη χώρα μας υπάρχουν κλινικές που την εκτελούν και την κλινική εξέταση (περιφερικό αιθουσαίο σύνδρομο) και το μόνο θεραπευτικό μέτρο είναι η διακοπή της χορήγησης του φαρμάκου.25,31 Προληπτικά, επιβάλλεται η αποφυγή ταυτόχρονης χορήγησης φουροσεμίδης, η οποία αυξάνει τη συγκέντρωση των ουσιών αυτών στην περιλέμφο, ενώ ενδέχεται να είναι ωφέλιμη η ταυτόχρονη χορήγηση αντιοξειδωτικών ουσιών αν και, σε αντίθεση με την νεφροτοξίκωση, αυτό δεν έχει αποδειχθεί για την ωτοτοξική δράση των αμινογλυκοσιδικών αντιμικροβιακών στο σκύλο και τη γάτα.31
Η νευροτοξίκωση είναι σπάνια και οφείλεται σε αναστολή απελευθέρωσης της ακετυλοχολίνης στις νευρομυϊκές συνάψεις.3,25 Στην εμφάνισή της προδιαθέτει η χορήγηση γενικής αναισθησίας και η κλινική εικόνα χαρακτηρίζεται από χαλαρή πάρεση ή παράλυση των άκρων και μπορεί να καταλήξει ακόμη και σε αναπνευστική ανεπάρκεια λόγω παράλυσης των μυών της αναπνοής.3,25 Θεραπευτικά προτείνεται η αργή ενδοφλέβια χορήγηση ασβεστίου (χλωριούχο ασβέστιο σε δόση 10-20mg/kg Σ.Β. ή γλυκονικό ασβέστιο σε δόση 30-60mg/kg Σ.Β.) και ενδεχομένως νεοστιγμίνης (0,04-0,05mg/kg Σ.Β. υποδόρια ή ενδομυϊκά) ή χλωριούχου εδροφώνιου (0,1-0,2mg/kg Σ.Β. ενδοφλέβια).25
> Τοξίκωση από μακροκυκλικές λακτόνες στο σκύλο και τη γάτα
Οι μακροκυκλικές λακτόνες διακρίνονται στις αβερμεκτίνες (αβαμεκτίνη, δοραμεκτίνη, επρινομεκτίνη, ιβερμεκτίνη, σελαμεκτίνη) και τις μιλμπεμυκίνες (μιλμπεμυκίνη, μοξιδεκτίνη, νεμαδεκτίνη) και είναι παρασιτοκτόνα με ευρύ φάσμα, αποτελεσματικά κατά των νηματωδών σκωλήκων (συμπεριλαμβανόμενων των μικροφιλαριών) και των αραχνιδών και κατά δεύτερο λόγο κατά των εντόμων.6 Οι ουσίες αυτές δρουν κυρίως ως αγωνιστές των διαύλων χλωρίου και κατά δεύτερο λόγο αυξάνοντας την έκλυση του γ-αμινοβουτυρικού οξέος στα ευαίσθητα παράσιτα προκαλώντας έτσι παράλυση και τελικά το θάνατό τους.6 Στο εμπόριο κυκλοφορούν σε διάφορες φαρμακοτεχνικές μορφές (για χορήγηση από το στόμα, παρεντερικά, τοπικά και σε μορφή διαλύματος επίχυσης που απορροφάται συστηματικά), μερικές φορές σε συνδυασμό με άλλα αντιπαρασιτικά φάρμακα και με διαφορετικές ενδείξεις και αντενδείξεις, ανάλογα με το σκεύασμα, το προτεινόμενο δοσολογικό σχήμα και το ζωικό είδος για το οποίο προορίζονται.6 Στην καθημερινή κλινική πράξη χρησιμοποιούνται ιδιαίτερα συχνά για την πρόληψη και τη θεραπεία μεγάλου αριθμού παρασιτώσεων του σκύλου και της γάτας.
Η χορήγησή τους είναι ασφαλής όταν χρησιμοποιούνται σύμφωνα με τις οδηγίες του παρασκευαστή.6,32,33 Αντίθετα, η χρησιμοποίηση σκευ- ασμάτων που προορίζονται για τα παραγωγικά ζώα και η χορήγηση μεγάλων δόσεων μπορεί να προκαλέσει νευροτοξίκωση (τοξίκωση τύπου Α).6,34 Για παράδειγμα, η ιβερμεκτίνη ήταν η υπεύθυνη ουσία στο 2,1% των περιπτώσεων τοξίκωσης σε ζώα συντροφιάς που καταγράφηκαν στις Η.Π.Α. το 2009.2 Η νευροτοξίκωση οφείλεται στην αυξημένη συγκέντρωση των ουσιών αυτών στο κεντρικό νευρικό σύστημα του ξενιστή, όπου υπάρχουν δίαυλοι χλωρίου και γ-αμινοβουτυρικό οξύ, δρώντας με μηχανισμούς παρόμοιους με εκείνους μέσω των οποίων σκοτώνουν τα ευαίσθητα παράσιτα.6 Τα συμπτώματα μπορούν να εμφανιστούν μέσα σε λίγες ώρες από την πρώτη χορήγηση ή ακόμα και ύστερα από αρκετές ημέρες ή εβδομάδες σε περίπτωση μακροχρόνιας θεραπείας (π.χ. για τη γενικευμένη δεμοδήκωση του σκύλου) και χαρακτηρίζονται από μειωμένο επίπεδο συνείδησης, αποπροσανατολισμό, επιληπτικές κρίσεις, μυδρίαση (ή ορισμένες φορές μύση στη γάτα), τύφλωση (λόγω οιδήματος του αμφιβληστροειδή), σιελόρροια, αταξία, μυϊκό τρόμο, βραδυκαρδία και αναπνευστική ανεπάρκεια και μπορεί να οδηγήσουν στο θάνατο του ζώου.3,6,35-43 Η πιθανότητα νευροτοξίκωσης από μακροκυκλικές λακτόνες εξαρτάται από: α) τη δραστική ουσία, αφού για παράδειγμα η ιβερμεκτίνη και η μοξιδεκτίνη θεωρούνται πε- ρισσότερο τοξικές σε σχέση με τη σελαμεκτίνη,32,33 β) το δοσολογικό σχήμα και συγκεκριμένα από τη δόση και τη διάρκεια της χορήγησης,38,43 γ) την παρουσία μεταλλάξεων του γονιδίου ABCB-1 που μειώνουν τη λειτουργική ικανότητα της P-gp.6,34,38,44 Για παράδειγμα, σκύλοι της φυλής Collie που είναι ομοζύγωτοι για τη μετάλλαξη nt228 (del4) εμφανίζουν συμπτώματα τοξίκωσης ύστερα από μια χορήγηση ιβερμεκτίνης στη δόση των 0,1-0,12mg/kg Σ.Β., οι ετεροζύγωτοι σκύλοι ύστερα από επί μακρό χορήγηση στην ημερήσια δόση των 0,3mg/kg Σ.Β., ενώ οι σκύλοι χωρίς μετάλλαξη δεν παρουσιάζουν τοξίκωση ύστερα από μακροχρόνια χορήγηση στην ημερήσια δόση των 0,6mg/kg Σ.Β. ή την άπαξ χορήγηση σε δόση μέχρι και 2mg/kg Σ.Β.4,6,42 Κατά παρόμοιο τρόπο, σκύλοι με τη γονιδιακή μετάλλαξη εμφανίζουν συμπτώματα τοξίκωσης ύστερα από μια χορήγηση μοξιδεκτίνης στη δόση των 0,09mg/kg Σ.Β., ενώ σκύλοι χωρίς τη μετάλλαξη σε δόση 1,9-2,8mg/kg Σ.Β.6 Αντίθετα, οι σκύλοι της φυλής Collieπου είναι ευαίσθητοι στην ιβερμεκτίνη συνήθως δεν εμφανίζουν συμπτώματα τοξίκωσης ύστερα από χορήγηση μιλμπεμυκίνης σε δόση μικρότερη από 5mg/kg Σ.Β., και η ημερήσια δόση των 1-2mg/kg Σ.Β.θεωρείται ασφαλής, αν και έχουν καταγραφεί σποραδικά περιστατικά τοξίκωσης και με το δοσολογικό αυτό σχήμα,6,34 δ) την ταυτόχρονη χορήγηση άλλων φαρμάκων που αναστέλλουν τη δράση της P-gp (Πίνακας 2)6,43 και ε) ενδεχομένως από την ηλικία, αφού τα πολύ νεαρά και τα υπερήλικα ζώα ενδέχεται να είναι περισσότερο ευαίσθητα.6,40 Η τοξίκωση από μακροκυκλικές λακτόνες αναφέρεται συχνότερα στο σκύλο σε σχέση με τη γάτα [ενδεχομένως λόγω της μετάλλαξης nt228 (del4) και της συχνότερης χορήγησής τους στον πρώτο σε μεγάλες δόσεις για τη θεραπεία των εξωπαρασιτώσεων και ιδιαίτερα της γενικευμένης δεδοδήκωσης] και συχνότερα για την ιβερμεκτίνη σε σχέση με τη μιλμπεμυκίνη και τη μοξιδεκτίνη (ενδεχομένως λόγω της συχνότερης χορήγησης της πρώτης σε μεγάλες δόσεις).38,43
Η διάγνωση στηρίζεται στο ιστορικό, την κλινική εικόνα και την κλινική βελτίωση ύστερα από τη διακοπή χορήγησης του υπεύθυνου φαρμάκου, αν και η τελευταία δεν πρέπει να θεωρείται δεδομένη και μπορεί να διαπιστωθεί ύστερα από χρονικό διάστημα αρκετών ημερών ή ακόμα και εβδομάδων, ιδιαίτερα ύστερα από χορήγηση μεγάλων δόσεων σε σκύλους με τη μετάλλαξη nt228 (del4), λόγω της μακράς περιόδου ημίσειας ζωής των ουσιών αυτών.6,36,42 Εκτός από τα συνήθη συμπτωματικά μέτρα (π.χ. αποτοξίκωση, αντιεπιληπτική αγωγή, μηχανική υποστήριξη αναπνοής),37,42 σε βαριές περιπτώσεις τοξίκωσης από μακροκυκλικές λακτόνες στο σκύλο έχει χρησιμοποιηθεί με ενθαρρυντικά αποτελέσματα η ενδοφλέβια χορήγηση διαλύματος λιπιδίων 20% (π.χ. Intralipid®) στην αρχική δόση των 1,5ml/kg Σ.Β. σε διάστημα 1-15min ακολουθούμενη από χορήγη- ση στάγδην στη δόση των 0,25-0,5ml/kg Σ.Β./min για 30-60min που, εφόσον δε διαπιστωθεί μακροσκοπική υπερλιπιδαιμία στον ορό ή το πλάσμα του αίματος, μπορεί να επαναληφθεί σε μεσοδιαστήματα 4-6 ωρών, άλλη μια ή δύο φορές.6,35,37,45,46 Ο πιθανότερος μηχανισμός δράσης των λιπιδίων είναι η δέσμευση των λιποδιαλυτών αυτών ουσιών και η επιτάχυνση της απομάκρυνσή τους από τον οργανισμό.2,6,35,46 Λόγω έλλειψης επαρκών επιστημονικών δεδομένων και κατάλληλα σχεδιασμένων μελετών και της πιθανότητας παρενεργειών (υπερλιπιδαιμία, αιμόλυση, λιπώδης εμβολή, σηψαιμία), προς το παρόν η αγωγή αυτή συνιστάται μόνο στα περιστατικά εκείνα όπου η κλινική εικόνα είναι βαριά και δε διαπιστώνεται ικανοποιητική ανταπόκριση στη συνήθη θεραπευτική αντιμετώπιση.6,41,45,46 Παραδοσιακά, για την αντιμετώπιση της τοξίκωσης από μακροκυκλικές λακτόνες χρησιμοποιείται η φυσοστιγμίνη (0,02-0,06mg/kg Σ.Β. ή 1mg/σκύλο, κάθε 12 ώρες, αργά ενδοφλέβια) που, αν και έχει σύντομη δράση (30-90min), επιτρέπει στο ζώο να ανακτήσει τη συνείδηση και ενδεχομένως να καταναλώσει τροφή και νερό.3,6,47
Προληπτικά, τόσο στο σκύλο (ανεξάρτητα από τη φυλή) όσο και στη γάτα, πρέπει να χρησιμοποιούνται μόνο τα εγκεκριμένα σκευάσματα με μακροκυκλικές λακτόνες στο αναγραφόμενο και κατά τεκμήριο ασφαλές δοσολογικό σχήμα. Στις περιπτώσεις όμως εκείνες όπου αυτό δεν είναι εφικτό, όπως για παράδειγμα σε σκύλους με γενικευμένη δεμοδήκωση όταν ο ιδιοκτήτης δε μπορεί να ανταπεξέλθει οικονομικά στο κόστος της θεραπείας με μιλμπεμυκίνη, επιβάλλεται: α) να μη χορηγούνται τοξικές δόσεις των ουσιών αυτών αν δεν προηγηθεί γενετικός έλεγχος για τη μετάλλαξη nt228 (del4) τουλάχιστον στους σκύλους των φυλών αυξημένου κινδύνου (Πίνακας 3), β) η προοδευτική αύξηση της δόσης (για παράδειγμα, σε σκύλους με γενικευμένη δεμοδήκωση έχει προταθεί η ημερήσια θεραπεία με ιβερμεκτίνη από το στόμα να ξεκινά από τη δόση των 0,1mg/kg Σ.Β. και να αυξάνει προοδευτικά κατά 0,1mg/kg Σ.Β. μέχρι την τελική δόση των 0,6mg/kg Σ.Β.), γ) η συνεχής παρακολούθηση του ζώου σε όλη τη διάρκεια της θεραπείας και η άμεση διακοπή της σε περίπτωση εμφάνισης πρόδρομων συμπτωμά- των τοξίκωσης, που συνήθως είναι η μυδρίαση και η σιελόρροια, και δ) η αποφυγή ταυτόχρονης χορήγησης άλλων φαρμάκων που αναστέλλουν την P-gp (Πίνακας 2).43 Επισημαίνεται ότι τα μέτρα αυτά μπορούν να μειώσουν, όχι όμως να εκμηδενίσουν, την πιθανότητα τοξίκωσης ενώ παράλληλα επιτρέπουν την έγκαιρη διάγνωση της τελευταίας, βελτιώνοντας έτσι την πρόγνωση.34,38,43,44
> Τοξίκωση από πυρεθρινοειδή στη γάτα
Τα πυρεθρινοειδή (π.χ. δελταμεθρίνη, περμεθρίνη) χρησιμοποιούνται συχνά στο σκύλο, κυρίως επειδή η ταχεία και ευρέος φάσματος εξωπαρασιτοκτόνος δράση τους κατά των κροτώνων, των ακάρεων και των εντόμων, συνδυάζεται με την εντομοαπωθητική τους ικανότητα.48-50 Δρουν στο νευρικό σύστημα των ευαίσθητων παρασίτων και συγκεκριμένα στις αντλίες νατρίου προκαλώντας είτε συνεχή διέγερση και σπαστική παράλυση (πυρεθρινοειδή τύπου Ι όπως η περμεθρίνη) ή χαλαρή παράλυση λόγω αναστολής της μετάδοσης των ώσεων (πυρεθρινοειδή τύπου ΙΙ όπως η δελταμεθρίνη).48,49 Στο εμπόριο διατίθενται σε διάφορες φαρμακοτεχνικές μορφές (σαμπουάν, διαλύματα επίχυσης, εκνεφωτήρες σταγονιδίων, περιλαίμια) οι περισσότερες από τις οποίες είναι εγκεκριμένες μόνο για το σκύλο, στον οποίο είναι κατά τεκμήριο ασφαλείς όταν χρησιμοποιούνται σύμφωνα με τις οδηγίες του παρασκευαστή.48
Η τοξίκωση από πυρεθρινοειδή είναι αρκετά συχνή στη γάτα.48,50 Μάλιστα, η τοξίκωση από περμεθρίνη ήταν η συχνότερη τοξίκωση των ζώων συντροφιάς από εξωπαρασιτοκτόνα φάρμακα κτηνιατρικής χρήσης στις Η.Π.Α. το 2009.1 Η αυξημένη ευαισθησία του ζωικού αυτού είδους οφείλεται στη μειωμένη δραστηριότητα των ενζύμων που είναι υπεύθυνα για το μεταβολισμό των πυρεθρινοειδών στο ήπαρ (τοξίκωση τύπου Α) και συγκεκριμένα της γλυκουρονικής τρανσφεράσης.1,49 Η τοξίκωση μπορεί να διαπιστωθεί όχι μόνο όταν τα εξωπαρασιτοκτόνα αυτά χρησιμοποιούνται εκ παραδρομής σε γάτες αλλά και ύστερα από έκθεση των τελευταίων σε σκύλους στους οποίους έγινε πρόσφατα τοπική εφαρμογή πυρεθρινοειδών,48,49,51-55 γεγονός για το οποίο πρέπει να ενημερώνονται οι ιδιοκτήτες σκύλων που ζουν μαζί με γάτες. Τα συμπτώματα, που συνήθως εμφανίζονται μέσα σε λίγες ώρες και μέχρι 3 ημέρες μετά την έκθεση, χαρακτηρίζονται από σιελόρροια, γενικευμένο μυϊκό τρόμο, αταξία, υπεραισθησία, παραισθησία, υπερδιέγερση και επιληπτικές κρίσεις και μπορεί να καταλήξουν στο θάνατο του ζώου.48-50,52,55,56 Λόγω της έντονης μυϊκής δραστηριότητας συχνά διαπιστώνεται υπερθερμία και σπανιότερα μυοσφαιρινουρία που μπορεί να προκαλέσει οξεία νεφρική ανεπάρκεια.49,55 Σε περίπτωση επιτυχούς έκβασης αναμένεται ανάρρωση συνήθως ύστερα από 2-3 ημέρες και σπανιότερα μετά από μια εβδομάδα.49,56
Η διάγνωση στηρίζεται στο ιστορικό και τη συμβατή κλινική εικόνα και, θεωρητικά τουλάχιστον, μπορεί να επιβεβαιωθεί με τη μέτρηση της συγκέντρωσης της υπεύθυνης ουσίας σε διάφορους ιστούς, μεταξύ των οποίων το δέρμα και το τρίχωμα.49,50 Η θεραπευτική αντιμετώπιση περιλαμβάνει την αποτοξίκωση (για την απομάκρυνση των λιπόφιλων αυτών ουσιών από το δέρμα συνιστάται η χρήση απορρυπαντικού πιάτων),48 την υποστηρικτική αγωγή, τον έλεγχο των επιληπτικών κρίσεων (διαζεπάμη, βαρβιτουρικά, προποφόλη, εισπνευστικά αναισθητικά)45,48,49,52 και του μυϊκού τρόμου με τη χορήγηση μεθοκαρβαμόλης (4450mg/kg Σ.Β., ενδοφλέβια που επαναλαμβάνεται όσο συχνά χρειάζεται μέχρι της συνολικής ημερήσιας δόσης των 330mg/kg Σ.Β.) που έχει μυοχαλαρωτική δράση.45,48,49,55 Επιπλέον, όπως στην περίπτωση της τοξίκωσης από μακροκυκλικές λακτόνες, έχει προταθεί η ενδοφλέβια χορήγηση διαλύματος λιπιδίων 20%, χωρίς όμως να υπάρχει επαρκής επιστημονική τεκμηρίωση για την αποτελεσματικότητα και την ασφάλειά της.46,48,52,57 Η πρόγνωση είναι επιφυλακτική αν και περίπου το 85-95% των γατών αναρρώνει πλήρως εφόσον εφαρμοστεί έγκαιρα η κατάλληλη θεραπευτική αγωγή.49,50,52,54,56 Προληπτικά επιβάλλεται η με κάθε τρόπο αποφυγή άμεσης ή έμμεσης έκθεσης της γάτας στις ουσίες αυτές, ιδιαίτερα όταν οι τελευταίες βρίσκονται σε μεγάλη συγκέντρωση, όπως συμβαίνει στα διαλύματα επίχυσης για σκύλους.54,56 Για το λόγο αυτό, ο συγγραφέας αποφεύγει κατά το δυνατό τη χορήγηση των τελευταίων σε σκύλους που έρχονται σε στενή επαφή με γάτες.54
> Τοξίκωση από μη στεροειδή αντιφλεγμονώδη στο σκύλο και τη γάτα
Τα μη στεροειδή αντιφλεγμονώδη (Μ.Σ.ΑΦ.) χρησιμοποιούνται συχνά στην κλινική πράξη, κυρίως για την αντιμετώπιση του πυρετού, της φλεγμονής και του πόνου.58,59 Ο κυριότερος μηχανισμός δράσης τους περιλαμβάνει την εκλεκτική αναστολή του ενζύμου κυκλοξυγενάση-2 (COX-2) που είναι απαραίτητο για το μεταβολισμό του αραχιδονικού οξέος και την παραγωγή των μεταβιβαστών της φλεγμονής και ιδιαίτερα των προσταγλανδινών.58,59 Στο εμπόριο υπάρχουν σκευάσματα για κτηνιατρική και ανθρώπινη χρήση που χορηγούνται τοπικά, παρεντερικά και από το στόμα. Αν και κατά κανόνα τα σκευάσματα για ανθρώπινη χρήση είναι περισσότερο τοξικά, δυστυχώς χρησιμοποιούνται ακόμα αν και όχι στο βαθμό που αυτό συνέβαινε παλαιότερα.
Η τοξικότητά των Μ.Σ.ΑΦ. οφείλεται κυρίως στην αναστολή της κυκλοξυγενάσης-1 (COX-1), αφορά κατά κύριο λόγο τον πεπτικό σωλήνα (γαστροδωδεκαδακτυλικά έλκη) και σε μεγαλύτερες κατά κανόνα δόσεις τους νεφρούς (τοξίκωση τύπου Α) και είναι ιδιαίτερα συχνή.1,58 Για παράδειγμα, η ιβουπροφαίνη (Advil®, Algofren®, Brufen®, Nurofen ®) ήταν το δεύτερο σε συχνότητα φάρμακο που ευθύνονταν για τοξίκωση στο σκύλο και στη γάτα στις Η.Π.Α. το 2009.1 Η εμφάνιση των ελκών οφείλεται κυρίως στην αναστολή της σύνθεσης των προσταγλαδινών που είναι απαραίτητες για τον έλεγχο της υπερπαραγωγής γαστρικού οξέος, για την παραγωγή βλέννης και διττανθρακικών και για τη διατήρηση της φυσιολογικής ροής του αίματος στον πεπτικό σωλήνα3,58,59 και είναι συχνότερη όταν χορηγούνται παράλληλα με γλυκοκορτικοειδή.59 Η νεφροτοξική δράση των Μ.Σ.ΑΦ. οφείλεται στην αναστολή της σύνθεσης των προσταγλαδινών Ε2 και Ι2 που είναι απαραίτητες για την αγγειοδιαστολή των νεφρικών αρτηριδίων3,58,59 και διαπιστώνεται πιο συχνά σε υπερήλικα ζώα, όταν συνυπάρχουν άλλες παθολογικές καταστάσεις που μειώνουν τη ροή του αίματος στους νεφρούς, όπως η καρδιακή και η νεφρική ανεπάρκεια και η υπόταση αλλά και όταν χορηγούνται ταυτόχρονα άλλα νεφροτοξικά φάρμακα.3,58 Επιπλέον, τα γαστροδωδεκαδακτυλικά έλκη και η νεφροτοξίκωση από Μ.Σ.ΑΦ. διαπιστώνονται συχνότερα ύστερα από χορήγηση σκευασμάτων για ανθρώπινη χρήση, επειδή περιέχουν σχετικά μεγάλες συγκεντρώσεις των υπεύθυνων ουσιών και ενδεχομένως επειδή οι τελευταίες είναι λιγότερο εκλεκτικές σε ότι αφορά την αναστολή της δράσης της COX-2 (στο σκύλο η τοξική δόση της ιβουπροφαίνης φαίνεται ότι είναι μικρότερη από τη θεραπευτική),3,58,59 σκευασμάτων που χορηγούνται από το στόμα, σε μεγάλη δόση ή για μεγάλο χρονικά διάστημα59,60 και στις γάτες σε σύγκριση με τους σκύλους.58 Επισημαίνεται πάντως ότι, ακόμα και για τα νεότερης γενιάς Μ.Σ.ΑΦ. που είναι εγκεκριμένα για τα ζώα συντροφιάς και είναι σε μεγάλο βαθμό ασφαλή, δε μπορεί να αποκλειστεί η πιθανότητα τοξίκωσης, ιδιαίτερα όταν συντρέχουν ορισμένοι από τους παραπάνω προδιαθετικούς παράγοντες.59
Η διάγνωση της τοξίκωσης από Μ.Σ.ΑΦ. στηρίζεται στο ιστορικό χορήγησης και την κλινική εικόνα. Εκτός από την αποτοξίκωση και την υποστηρικτική αγωγή, η θεραπευτική αντιμετώπιση είναι εκείνη των γαστροδωδεκαδακτυλικών ελκών (σουκραλφάτη, Η2-αναστολείς ή αναστολείς της αντλίας πρωτονίων, αντιεμετικά, μετάγγιση αίματος)3,58 και της οξείας νεφρικής ανεπάρκειας (ενδοφλέβια χορήγηση κρυσταλλοειδών, διουρητικά, δοπαμίνη)58 με την προσθήκη της μισοπροστόλης (0,002-0,005mg/kg Σ.Β. κάθε 8 ή 12 ώρες από το στόμα), που είναι συνθετικό ανάλογο της προσταγλανδίνης Ε1 και έχει θεραπευτική δράση στην ελκώδη γαστρεντερίτιδα και ενδεχομένως στη νεφροτοξίκωση από Μ.Σ.ΑΦ.3,58,60 Προληπτικά πρέπει να αποφεύγονται ή να αποκλείονται με τον ανάλογο εργαστηριακό έλεγχο που προηγείται όλα τα προδιαθετικά αίτια και επιπλέον, ιδιαίτερα σε ζώα αυξημένου κινδύνου, να χορηγείται μισοπροστόλη.3,60
Ιδιαίτερη περίπτωση τοξίκωσης από Μ.Σ.ΑΦ. αποτελεί η ηπατοτοξίκωση από καρπροφαίνη στο σκύλο. Η καρπροφαίνη προκαλεί ηπατοτοξίκωση τύπου Β, με μηχανισμούς που δεν είναι καλά διευκρινισμένοι, και μπορεί να οδηγήσει σε ηπατική ανεπάρκεια.3,59,61Τα συχνότερα συμπτώματα είναι η ανορεξία, οι έμετοι και ο ίκτερος και τα κυριότερα εργαστηριακά ευρήματα η αυξημένη δραστηριότητα της ALT και της ALP και η υπερχολερυθριναιμία.61 Η πρόγνωση είναι σχετικά ευνοϊκή αφού οι περισσότεροι σκύλοι εμφανίζουν κλινική και εργαστηριακή βελτίωση ύστερα από την έγκαιρη διακοπή της χορήγησης του φαρμάκου και τη χορήγηση συμπτωματικής και υποστηρικτικής θεραπείας.61 Για το λόγο αυτό συνιστάται η τακτική κλινική και εργαστηριακή παρακολούθηση της ηπατικής λειτουργίας, ιδιαίτερα όταν η παραπάνω φαρμακευτική ουσία χρησιμοποιείται επί μακρό (π.χ. σε σκύλους με οστεοαρθρίτιδα).
Μια ακόμα ιδιαίτερη περίπτωση τοξίκωσης από Μ.Σ.ΑΦ. είναι εκείνη από παρακεταμόλη (ακεταμινοφαίνη) στη γάτα και το σκύλο. Η παρακεταμόλη (Apotel®, Depon®, Panadol®, Protalgon® κλπ) χρησιμοποιείται ευρύτατα ως αναλγητικό και αντιπυρετικό φάρμακο στον άνθρωπο, όπου μεταβολίζεται μέσω γλυκουρονίδωσης σε μη τοξικούς μεταβολίτες. Η τοξίκωση από παρακεταμόλη στις γάτες ήταν η συχνότερη τοξίκωση από φάρμακα για ανθρώπινη χρήση στις Η.Π.Α. το 20091 και οφείλεται στη σχετική έλλειψη της γλυκουρονικής τρανσφεράσης στο ζωικό αυτό είδος, που έχει ως αποτέλεσμα η δραστική ου- σία να μεταβολίζεται αρχικά με τη μεταβολική οδό της σούλφωσης και στη συνέχεια με εκείνη της υδροξυλίωσης, μέσω της οποίας παράγεται το N-acetyl-para-benzoquinoneimine (NAPQUI) που ευθύνεται για την οξεία ηπατική νέκρωση, τη μεθαιμοσφαιριναιμία και την αιμολυτική αναιμία με σωμάτια Heinz.3,62,63 Τοξίκωση από παρακεταμόλη με παρόμοιες εκδηλώσεις έχει περιγραφεί και στο σκύλο αν και λιγότερο συχνά σε σύγκριση με τη γάτα.60,64,65 Πρόκειται για τοξίκωση τύπου Α που συνήθως εμφανίζεται λίγες ώρες ύστερα από μια χορήγηση της υπεύθυνης ουσίας σε μεγάλη δόση60 και ενδέχεται να είναι συχνότερη στις αρ- σενικές σε σχέση με τις θηλυκές γάτες.62 Κλινικά διαπιστώνεται κατάπτωση, κυάνωση, ταχύπνοια, υποδόρια οιδήματα και σε βαριά περιστατικά κώμα και θάνατος, ενώ στα συχνότερα εργαστηριακά ευρήματα περιλαμβάνονται η αναιμία, η αυξημένη δραστηριότητα της ALT και της ALP και η υπερχολερυθριναιμία.66,67 Θεραπευτικά χρησιμοποιείται η Ν-ακετυλοκυστεϊνη (ενδοφλέβια ή από το στόμα στην αρχική δόση των 140-150mg/ kg Σ.Β. και στη συνέχεια στη δόση των 50-70mg/ kg Σ.Β. κάθε 4-6 ώρες για 5-17 φορές) η οποία μεταβολίζεται σε γλουταθειόνη που συνδέεται και απομακρύνει τους τοξικούς μεταβολίτες του φαρμάκου.3,45,60,62,63,66-68 Επικουρικά έχει προταθεί η χορήγηση σιμετιδίνης (5-10mg/kg Σ.Β., μέσα σε 48 ώρες από τη λήψη της παρακεταμόλης) που αναστέλλοντας τα μεταβολικά ένζυμα μπορεί να μειώσει τη σύνθεση των τοξικών μεταβολιτών του φαρμάκου3 και ηπατοπροστατευτικών και αντιοξειδωτικών ουσιών, όπως είναι η S-adenosyl-L- μεθειονίνη (SAMe στη δόση των 20mg/kg Σ.Β. κάθε 24 ώρες από το στόμα) και η σιλυμαρίνη (20-50mg/kg, κάθε 24 ώρες από το στόμα).45,65,67 Η χορήγηση παρακεταμόλης, ιδιαίτερα στη γάτα, πρέπει να αποφεύγεται με κάθε τρόπο και ιδιαίτερα σημαντική προς την κατεύθυνση αυτή είναι η σωστή ενημέρωση των ιδιοκτητών, αφού τις περισσότερες φορές χορηγούν τα ανθρώπινα σκευάσματα χωρίς να ζητήσουν τη συμβουλή του κτηνιάτρου.67
> Τοξίκωση από φαινοβαρβιτάλη στο σκύλο
Η φαινοβαρβιτάλη, που θεωρείται φάρμακο εκλογής για τη μακροχρόνια συμπτωματική αντιμετώπιση των επιληπτικών κρίσεων στο σκύλο,69 δρα κυρίως αυξάνοντας τη δράση του γ-αμινοβουτυρικού οξέως στο κεντρικό νευρικό σύστημα.69 Η ουσία αυτή μεταβολίζεται στο ήπαρ και σχετικά σπάνια, ύστερα από μακροχρόνια χορήγηση, προκαλεί ηπατοτοξίκωση (τύπου Α και ενδεχομένως τύπου Β) που μπορεί να αποβεί θανατηφόρος και λιγότερο συχνά επιπολής νεκρολυτική δερματίτιδα (ηπατοδερματικό σύνδρομο ή μεταβολική νέκρωση της επιδερμίδας).3,69-71
Τα συχνότερα συμπτώματα της ηπατοτοξίκωσης είναι η κατάπτωση, η ανορεξία, ο ασκίτης και η αιμορραγική διάθεση.70 Η διάγνωση δεν πρέπει να στηρίζεται μόνο στην αυξημένη δραστηριότητα της ALP και της ALT στο αίμα, αφού αυτό διαπιστώνεται και σε ζώα που λαμβάνουν το φάρμακο αλλά δεν εμφανίζουν ηπατοτοξίκωση. Για το λόγο αυτό, τα παραπάνω εργαστηριακά ευρήματα πρέπει να συνδυάζονται με την αυξημένη συγκέντρωση των χολικών οξέων και ενδεχομένως της ολικής χολερυθρίνης, τη μειωμένη συγκέντρωση των λευκωματινών, του αζώτου ουρίας και της χολοστερόλης στο αίμα και τα παθολογικά ευρήματα της υπερηχοτομογραφικής εξέτασης του ήπατος.3,69,70,72,73 Τα συμπτώματα και οι εργαστηριακές διαταραχές ενδέχεται να είναι αντιστρέψιμα αν η τοξίκωση διαγνωστεί έγκαιρα και διακοπεί η χορήγηση της φαινοβαρβιτάλης (αντικατάσταση από άλλο αντιεπιληπτικό φάρμακο) ή μειωθεί η δόση της, ενώ σε κάθε περίπτωση επιβάλλεται η έναρξη συμπτωματικής θεραπείας για την ηπατοπάθεια.70 Το καλύτερο προληπτικό μέτρο είναι η τακτική παρακολούθηση όχι μόνο των δεικτών της ηπατικής λειτουργίας αλλά και της συγκέντρωσης του φαρμάκου στο αίμα, ξεκινώντας περίπου 2-3 εβδομάδες μετά την έναρξη της θεραπείας ή την αύξηση της δοσολογίας του φαρμάκου69 και συνεχίζοντας κάθε 3-6 μήνες, αφού η πιθανότητα τοξίκωσης μεγαλώνει όταν η συγκέντρωσή του στο αίμα ξεπερνά τα 35-40μg/ml.3,69,70
Η επιπολής νεκρολυτική δερματίτιδα ύστερα από μακροχρόνια χορήγηση φαινοβαρβιτάλης χαρακτηρίζεται από δερματικές αλλοιώσεις, εργαστηριακά και απεικονιστικά ευρήματα που δε διαφέρουν από εκείνα των περιστατικών του ίδιου συνδρόμου που δε συνδέονται με τη χορήγηση του συγκεκριμένου φαρμάκου.71 Η διάγνωση στηρίζεται στην ιστοπαθολογική εξέταση από τις δερματικές αλλοιώσεις και την υπερηχοτομογραφική εξέταση του ήπατος, η θεραπεία είναι συμπτωματική και η πρόγνωση επιφυλακτική.71
> Τοξίκωση από διαζεπάμη στη γάτα
Η διαζεπάμη, που αυξάνει τη δραστηριότητα του γ-αμινοβουτυρικού οξέος στο κεντρικό νευρικό σύστημα και δρα ως ηρεμιστικό, αγχολυτικό, αντιεπιληπτικό και ορεξιογόνο,69 μπορεί να προκαλέσει οξεία και συχνά θανατηφόρο νέκρωση του ήπατος (τοξίκωση τύπου Β) στη γάτα με μηχανισμούς που δεν είναι καλά διευκρινισμένοι.3,69,74 Μάλιστα η τοξίκωση από διαζεπάμη φαίνεται να είναι συχνότερη ύστερα από βραχείας διάρκειας χορήγησή της ως διεγερτικού της όρεξης (χορήγηση άπαξ ή για λίγες ημέρες), χωρίς βέβαια να αποκλείεται σε περίπτωση μακροχρόνιας χορήγησης (π.χ ως αντιεπιληπτικού ή αγχολυτικού).3,74,75 Η διάγνωση στηρίζεται στην κλινική εικόνα (λήθαργος, αταξία, ανορεξία, ίκτερος, αιμορραγική διάθεση) και τον εργαστηριακό έλεγχο της ηπατικής λειτουργίας, η θεραπεία είναι συμπωματική και η πρόγνωση επιφυλακτική προς δυσμενής.74,75 Προληπτικά έχει προταθεί η μέτρηση της ALP πριν και μετά από 5 ημέρες θεραπείας και η άμεση διακοπή της χορήγησης του φαρμάκου σε περίπτωση αυξημένης δραστηριότητας του ενζύμου στη δεύτερη μέτρηση.74
> Τοξικώσεις από διάφορα άλλα φάρμακα
Πολλά ακόμα φάρμακα που χρησιμοποιούνται συ- χνά στην κτηνιατρική των ζώων συντροφιάς μπορούν να προκαλέσουν τοξίκωση, όπως: α) οι αναστολείς των διαύλων ασβεστίου (υπόταση, διαταραχές του καρδιακού ρυθμού),76 β) οι αναστολείς του ενζύμου μετατροπής της αγγειοπιεσίνης που μπορεί να οδηγήσουν σε νεφροτοξίκωση αφού η έλλειψη αγγειοπιεσίνης ΙΙ προκαλεί αγγειοδιαστολή στα απαγωγά αρτηρίδια των νεφρικών σπειραμάτων με αποτέλεσμα τη μείωση του ρυθμού σπειραματικής διήθησης.3 Μάλιστα όταν χορηγούνται σε σκύλους και γάτες με καρδιακή ανεπάρκεια η πιθανότητα νεφροτοξίκωσης αυξάνεται εφόσον η θεραπεία δεν οδηγήσει τελικά στην αντισταθμιστική αύξηση του κατά λεπτό όγκου αίματος,3 γ) τα αντινεοπλασματικά φάρμακα (μυελοτοξίκωση, γαστρεντερικές διαταραχές κλπ), δ) τα γλυκοκορτικοειδή (γαστρεντερικά έλκη), ε) η κετοκοναζόλη (ηπατοτοξίκωση, ιδιαίτερα στη γάτα),3 στ) η λοραταδίνη που είναι αντιισταμινικό δεύτερης γενιάς (μειωμένο ή αυξημένο επίπεδο συνείδησης, ταχυκαρδία),1 και ζ) η βιταμίνη D και ιδιαίτερα τα ανθρώπινα σκευάσματα που περιέχουν χολοκαλσιφερόλη (υπερασβεστιαιμία, νεφρική ανεπάρκεια).
> ΒΙΒΛΙΟΓΡΑΦΙΑ
1. McLean MK, Hansen SR. An overview of trends in animal poisoning cases in the United States: 2002-2010. Vet Clin North Am-Small AnimPract 2012, 42: 219-228.
2. Σαριδομιχελάκης Μ. Επείγοντα δερματολογικά περιστα- τικά στο σκύλο και τη γάτα. Ιατρική Ζώων Συντροφιάς 2013, 2: 23-43
3. Boothe DM. Drug-induced diseases. In: Small Animal Clinical Pharmacology and Therapeutics, Boothe DM (ed). 1stedn. WB Saunders: Philadelphia, 2001, pp. 41-59.
4. Mealey KL. Pharmacogenetics.Vet Clin North Am-Small AnimPract 2006, 36: 961-973.
5. Ginn PE. Immunohistochemical detection of P-glycoprotein in formalin-fixed and paraffin-embedded normal and neoplastic canine tissues.Vet Pathol 1996, 33: 533-541.
6. Merola VM, Eubig PA. Toxicology of avermectins and milbemycins (macrocylic lactones) and the role of P-glycoprotein in dogs and cats.Vet Clin North Am-Small AnimPract 2012, 42: 313-333.
7. Palmeiro BS. Cyclosporine in veterinary dermatology.Vet Clin North Am-Small AnimPract 2013, 43: 153-171.
8. Tappin SW, Goodfellow MR, Peters IR, Day MJ, Hall EJ, Mealey KL. Frequency of the mutant MDR1 allele in dogs in the UK.Vet Rec 2012, 171: 72.
9. Neff MW, Robertson KR, Wong AK, Safra N,Broman KW,Slatkin M,Mealey KL,Pedersen NC. Breed distribution and history of canine mdr1-1Delta, a pharmacogenetic mutation that marks the emergence of breeds from the collie lineage. ProcNatlAcadSci U S A 2004, 101: 11725-11730.
10. Mealey KL, Bentjen SA, Waiting DK. Frequency of the mutant MDR1 allele associated with ivermectin sensitivity in a sample population of collies from the northwestern United States. Am J Vet Res 2002, 63: 479-481.
11. Hugnet C, Bentjen SA, Mealey KL. Frequency of the mutant MDR1 allele associated with multidrug sensitivity in a sample of collies from France. J Vet PharmacolTher 2004, 27: 227-229.
12. Geyer J, Döring B, Godoy JR, Leidolf R, Moritz A, Petzinger E. Frequency of the nt230 (del4) MDR1 mutation in Collies and related dog breeds in Germany. J Vet PharmacolTher 2005, 28: 545-551.
13. Gramer I, Leidolf R, Döring B, Klintzsch S, Krämer EM, Yalcin E, Petzinger E, Geyer J. Breed distribution of the nt230(del4) MDR1 mutation in dogs. Vet J 2011, 189: 67-71.
14. McEntee M, Silverman JA, Rassnick K, Zgola M,Chan AO,Tau PT,Page RL. Enhanced bioavailability of oral docetaxel by coadministration of cyclosporin A in dogs and rats.Vet Comp Oncol 2003, 2: 105-112.
15. Sartor LL, Bentjen SA, Trepanier L, Mealey KL. Loperamide toxicity in a collie with the MDR1 mutation associated with ivermectin sensitivity. J Vet Intern Med 2004, 18: 117-118.
16. Mealey KL, Northrup NC, Bentjen SA. Increased toxicity of P-glycoprotein-substrate chemotherapeutic agents in a dog with the MDR1 deletion mutation associated with ivermectin sensitivity. J Am Vet Med Assoc 2003, 223: 1453-1455.
17. Trepanier LA. Cytochrome P450 and its role in veterinary drug interactions.Vet Clin North Am-Small AnimPract 2006, 36: 975-985.
18. Court MH, Hay-Kraus BL, Hill DW, Kind AJ, Greenblatt DJ. Propofol hydroxylation by dog liver microsomes: assay development and dog breed differences. Drug MetabDispos 1999, 27: 1293-1299.
19. Paulson SK, Engel L, Reitz B, Bolten S, Burton EG, Maziasz TJ, Yan B, Schoenhard GL. Evidence for polymorphism in the canine metabolism of the cyclooxygenase 2 inhibitor, celecoxib.Drug MetabDispos 1999, 27: 1133-1142.
20. Shou M, Norcross R, Sandig G, Lu P, Li Y, Lin Y, Mei Q,Rodrigues AD, Rushmore TH. Substrate specificity and kinetic properties of seven heterologously expressed dog cytochromes p450. Drug MetabDispos 2003, 31: 1161-1169.
21. Hirt RA, Teinfalt M, Dederichs D, van den Hoven R. The effect of orally administered marbofloxacin on the pharmacokinetics of theophylline.J Vet Med A 2003,50: 246-250.
22. Lu P, Singh SB, Carr BA, Fang Y, Xiang CD, Rushmore TH,Rodrigues AD,Shou M. Selective inhibition of dog hepatic CYP2B11 and CYP3A12. J PharmacolExpTher 2005, 313: 518-528.
23. Patricelli AJ, Hardie RJ, McAnulty JE. Cyclosporine and ketoconazole for the treatment of perianal fistulas in dogs.J Am Vet Med Assoc 2002, 220: 1009-1016.
24. Gray LL, Hillier A, Cole LK, Rajala-Schultz PJ. The effect of ketoconazole on whole blood and skin ciclosporin concentrations in dogs.Vet Dermatol 2013, 24: 118-125.
25. Dowling PM. Aminoglycosides. In: Antimicrobial Therapy in Veterinary Medicine.Giguere S, Prescott JF, Baggot JD, Walker RD,Dowling PM (eds). 4th edn. Blackwell Publishing: Ames, Iowa, 2006, pp. 207-229.
26. Albarellos G, Montoya L, Ambros L, Kreil V, Hallu R, Rebuelto M. Multiple once-daily dose pharmacokinetics and renal safety of gentamicin in dogs. J Vet PharmacolTher 2004, 27: 21-25.
27. Noli C, Morris D. Guidelines on the use of systemic aminoglycosides in veterinary dermatology. VetDermatol 2011, 22: 379-380.
28. Grauer GF, Greco DS, Behrend EN, Mani I, Fettman MJ, Allen TA. Estimation of quantitative enzymuria in dogs with gentamicin-induced nephrotoxicosis using urine enzyme/ creatinine ratios from spot urine samples.J VetInterMed 1995, 9: 324-327.
29. Frazier DL, Aucoin DP, Riviere JE. Gentamicin pharmacokinetics and nephrotoxicity in naturally acquired and experimentally induced disease in dogs. J Am Vet Med Assoc 1988, 192: 57-63.
30. Varzi HN, Esmailzadeh S, Morovvati H, Avizeh R, Shahriari A, Givi ME. Effect of silymarin and vitamin E on gentamicininduced nephrotoxicity in dogs.J Vet PharmacolTher 2007, 30: 477-481.
31. Oishi N, Talaska AE, Schacht J. Ototoxicity in dogs and cats. Vet Clin North Am-Small AnimPract 2012, 42: 1259-1271.
32. Krautmann MJ, Novotny MJ, De Keulenaer K, Godin CS,Evans EI,McCall JW,Wang C,Rowan TG,Jernigan AD. Safety of selamectin in cats.Vet Parasitol2000, 91: 393-403.
33. Novotny MJ, Krautmann MJ, Ehrhart JC, Godin CS,Evans EI,McCall JW,Sun F,Rowan TG,Jernigan AD. Safety of selamectin in dogs.Vet Parasitol 2000, 91: 377-391.
34. Barbet JL, Snook T, Gay JM, Mealey KL. ABCB1-1 Delta (MDR1-1 Delta) genotype is associated with adverse reactions in dogs treated with milbemycinoxime for generalized demodicosis. Vet Dermatol 2009, 20: 111-114.
35. Clarke DL, Lee JA, Murphy LA, Reineke EL. Use of intravenous lipid emulsion to treat ivermectintoxicosis in a Border Collie. J Am Vet Med Assoc 2011, 239: 1328-1333.
36. Tranquilli WJ, Paul AJ, Todd KS.Assessment of toxicosis induced by high-dose administration of milbemycinoxime in collies.Am J Vet Res 1991, 52: 1170-1172.
37. Crandell DE, Weinberg GL. Moxidectintoxicosis in a puppy successfully treated with intravenous lipids. J Vet EmergCrit Care 2009, 19: 181-186.
38. Merola V, Khan S, Gwaltney-Brant S. Ivermectintoxicosis in dogs: a retrospective study. J Am AnimHospAssoc 2009, 45: 106-111.
39. Kenny PJ, Vernau KM, Puschner B, Maggs DJ. Retinopathy associated with ivermectintoxicosis in two dogs. J Am Vet Med Assoc 2008, 233: 279-284.
40. Lewis DT, Merchant SR, Neer TM. Ivermectintoxicosis in a kitten.J Am Vet Med Assoc 1994, 205: 584-586.
41. Wright HM, Chen AV, Talcott PA, Poppenga RH, Mealey KL. Intravenous fat emulsion as treatment for ivermectintoxicosis in three dogs homozygous for the ABCB1-1Δ gene mutation.J Vet EmergCrit Care 2011, 21: 666-672.
42. Hopper K, Aldrich J, Haskins SC. Ivermectin toxicity in 17 collies. J Vet Intern Med 2002, 16: 89-94.
43. Bissonnette S, Paradis M, Daneau I, Silversides DW. The ABCB1-1Delta mutation is not responsible for subchronic neurotoxicity seen in dogs of non-collie breeds following macrocyclic lactone treatment for generalized demodicosis. Vet Dermatol2009, 20: 60-66.
44. Han JI, Son HW, Park SC, Na KJ. Novel insertion mutation of ABCB1 gene in an ivermectin-sensitive Border Collie. J Vet Sci 2010, 11: 341-344.
45. Khan SA. Common reversal agents/antidotes in small animal poisoning.Vet Clin North Am-Small AnimPract 2012, 42: 403-406.
46. Gwaltney-Brant S, Meadows I. Use of intravenous lipid emulsions for treating certain poisoning cases in small animals. Vet Clin North Am-Small AnimPract 2012, 42: 251-262.
47. Tranquilli WJ, Paul AJ, Seward RL, Todd KS, Dipietro JA. Response to physostigmine administration in collie dogs exhibiting ivermectintoxicosis. J Vet PharmacolTher 1987,10: 96-100.
48. Wismer T, Means C. Toxicology of newer insecticides in small animals. Vet Clin North Am-Small AnimPract 2012, 42: 335- 347.
49. Richardson JA. Permethrin so-on toxicose in cats.J Vet EmergCrit Care 2000, 10: 103-106.
50. Dymond NL, Swift IM. Permethrin toxicity in cats: a retrospective study of 20 cases. Aust Vet J 2008, 86: 219-223.
51. Turner V, Chaffey C, Ferrao P. A survey for small animal veterinarians regarding flea and tick control pesticide products. Can Vet J 2011, 52: 1080-1082.
52. Brückner M, Schwedes CS. Successful treatment of permethrintoxicosis in two cats with an intravenous lipid administration. TierärztlPraxAusg K Kleintiere Heimtiere 2012, 40: 129-134.
53. Linnett PJ. Permethrin toxicosis in cats. Aust Vet J 2008, 86: 32-35.
54. Malik R, Ward MP, Seavers A, Fawcett A, Bell E, Govendir M, Page S.Permethrin spot-on intoxication of cats: literature review and survey of veterinary practitioners in Australia. J Feline Med Surg 2010, 12: 5-14.
55. Boland LA, Angles JM. Feline permethrin toxicity: retrospective study of 42 cases. J Feline Med Surg 2010, 12: 61- 71.
56. Sutton NM, Bates N, Campbell A. Clinical effects and outcome of feline permethrin spot-on poisonings reported to the Veterinary Poisons Information Service (VPIS), London. J Feline Med Surg 2007, 9: 335-339.
57. Haworth MD, Smart L. Use of intravenous lipid therapy in three cases of feline permethrintoxicosis. J Vet EmergCrit Care 2012, 22: 697-702.
58. Khan SA, McLean MK. Toxicology of frequently encountered nonsteroidal anti-inflammatory drugs in dogs and cats. Vet Clin North Am-Small AnimPract2012,42: 289-306.
59. Clark TP. The clinical pharmacology of cyclooxygenase-2- selective and dual inhibitors.Vet Clin North Am-Small AnimPract 2006, 36: 1061-1085.
60. Villar D, Buck WB, Gonzalez JM. Ibuprofen, aspirin and acetaminophen toxicosis and treatment in dogs and cats.Vet Hum Toxicol1998, 40: 156-162.
61. MacPhail CM, Lappin MR, Meyer DJ, Smith SG, Webster CR, Armstrong PJ. Hepatocellular toxicosis associated with administration of carprofen in 21 dogs. J Am Vet Med Assoc 1998,212: 1895-1901.
62. Rumbeiha WK, Lin YS, Oehme FW. Comparison of N-acetylcysteine and methylene blue, alone or in combination, for treatment of acetaminophen toxicosis in cats.Am J Vet Res 1995, 56: 529-533.
63. Gaunt SD, Baker DC, Green RA. Clinicopathologic evaluation N-acetylcysteine therapy in acetaminophen toxicosis in the cat. Am J Vet Res1981, 42: 1982-1984.
64. MacNaughton SM. Acetaminophen toxicosis in a Dalmatian. Can Vet J 2003,44: 142-144.
65. Wallace KP, Center SA, Hickford FH, Warner KL, Smith S. S-adenosyl-L-methionine (SAMe) for the treatment of acetaminophen toxicity in a dog. J Am AnimHospAssoc 2002, 38: 246-254.
66. St Omer VV, McKnight ED. Acetylcysteine for treatment of acetaminophen toxicosis in the cat. J Am Vet Med Assoc 1980, 176: 911-913.
67. Avizeh R, Najafzadeh H, Razijalali M, Shirali S. Evaluation of prophylactic and therapeutic effects of silymarin and N-acetylcysteine in acetaminophen-induced hepatotoxicity in cats. J Vet PharmacolTher 2010, 33: 95-99.
68. Savides MC, Oehme FW, Leipold HW. Effects of various antidotal treatments on acetaminophen toxicosis and biotransformation in cats.Am J Vet Res 1985, 46: 1485-1489.
69. Dewey CW. Anticonvulsant therapy in dogs and cats. Vet Clin North Am-Small AnimPract2006, 36: 1107-1127.
70. Dayrell-Hart B, Steinberg SA, VanWinkle TJ, Farnbach GC. Hepatotoxicity of phenobarbital in dogs: 18 cases (1985-1989). J Am Vet Med Assoc 1991, 199: 1060-1066.
71. March PA, Hillier A, Weisbrode SE, Mattoon JS, Johnson SE, DiBartola SP, Brofman PJ.Superficial necrolytic dermatitis in 11 dogs with a history of phenobarbital administration (1995- 2002).J Vet Intern Med 2004,18: 65-74.
72. Gaskill CL, Miller LM, Mattoon JS, Hoffmann WE, Burton SA, Gelens HC, Ihle SL, Miller JB, Shaw DH, Cribb AE.Liver histopathology and liver and serum alanine aminotransferase and alkaline phosphatase activities in epileptic dogs receiving phenobarbital.Vet Pathol 2005, 42: 147-160.
73. Müller PB, Taboada J, Hosgood G, Partington BP,VanSteenhouse JL,Taylor HW,Wolfsheimer KJ. Effects of longterm phenobarbital treatment on the liver in dogs.J Vet Intern Med 2000, 14: 165-171.
74. Center SA, Elston TH, Rowland PH, Rosen DK, Reitz BL, Brunt JE, Rodan I, House J,Bank S,Lynch LR,Dring LA,Levy JK. Fulminant hepatic failure associated with oral administration of diazepam in 11 cats. J Am Vet Med Assoc 1996,209: 618-625.
75. Park FM. Successful treatment of hepatic failure secondary to diazepam administration in a cat. J Feline Med Surg 2012, 14: 158-160.
76. Hayes CL, Knight M. Calcium channel blocker toxicity in dogs and cats. Vet Clin North Am-Small AnimPract 2012, 42: 263-277.




