Θυμηθείτε πως...
Η διαχείριση των ιστολογικών δειγμάτων από τον κλινικό κτηνίατρο από την λήψη τους έως το ιστοπαθολογικό εργαστήριο
> Εισαγωγή
Ο κατάλληλος χειρισμός των ιστών από την δειγ- ματοληψία έως και την άφιξή τους στο εργαστήριο όπου θα πραγματοποιηθεί η ιστοπαθολογική εξέτασή τους είναι σημαντικός ώστε να αποφευχθούν αυτολυτικά φαινόμενα και σφάλματα τεχνικής κατά τους χειρισμούς που θα μπορούσαν να κάνουν δυσκολότερη ή και αδύνατη τη διάγνωση. Στην ερμηνεία, επίσης, των ιστοπαθολογικών ευρημάτων συμβάλλουν, μερικές φορές καθοριστικά, οι πληροφορίες που προσκομίζονται από τον κλινικό κτηνίατρο. Σε κάθε περίπτωση, το καλύτερο δυνατό αποτέλεσμα επιτυγχάνεται όταν υπάρχει συνεργασία ιστοπαθολόγου και κλινικού κτηνιάτρου γεγονός που προϋποθέτει έναν κοινό κώδικα επικοινωνίας. Παρακάτω παρατίθενται πληροφορίες για τον ενδεδειγμένο τρόπο μονιμοποίησης/συντήρησης και αποστολής/μεταφοράς δειγμάτων ιστών που λαμβάνονται με σκοπό την ιστοπαθολογική εξέταση.
> Μονιμοποίηση ιστών
Για την πλήρη και καλή παρατήρηση των ιστολο- γικών τομών είναι απαραίτητη η κατάλληλη και πλήρης μονιμοποίηση του ιστού.
Η μονιμοποίηση είναι απαραίτητη διότι:
- Προλαμβάνει την αυτόλυση και την ανάπτυξη βακτηρίων.
- Διατηρεί την προ του θανάτου αρχιτεκτονική δομή των ιστών.
- Επιφέρει τη σκλήρυνση των μαλακών ιστών ιστοτεμαχίων και έτσι γίνονται πιο εύκολοι οι περαιτέρω χειρισμοί των ιστών.
- Διατηρεί ή και ενισχύει τις απαιτούμενες ιδιότητές των ιστών για τη μετέπειτα εφαρμογή βιολογικών και χημικών χρώσεων.
Για την επίτευξη των παραπάνω θα πρέπει ο ιστός να τοποθετείται στο μονιμοποιητικό υγρό αμέσως μετά την λήψη του.
Η επιλογή του μονιμοποιητικού προσδιορίζεται από το σκοπό για τον οποίο ο ιστός θα υποστεί επεξεργασία και θα χρωσθεί ή θα διατηρηθεί. Το διάλυμα ουδέτερης φορμόλης (βλέπε παρακάτω) είναι το κυρίως χρησιμοποιούμενο υγρό διότι είναι συμβατό με πολλές χρωστικές.
Για την μονιμοποίηση χρησιμοποιούνται διάφορα χημικά υγρά ή φυσικοί παράγοντες όπως:
- Αλδεΰδες π.χ. φορμαλδεΰδη, γλουταραλδεΰδη.
- Οξειδωτικοί παράγοντες π.χ. τετροξείδιο του οσμίου, υπερμαγγανικό κάλιο.
- Χημικά μετουσίωσης-πήξης πρωτεϊνών (πηκτικοί παράγοντες) π.χ. οξικό οξύ, μεθυλική αλκοόλη, αιθυλική αλκοόλη.
- Φυσικοί παράγοντες π.χ. θερμότητα, μικροκύματα (φούρνος μικροκυμάτων), ψύξη.
- Άλλοι παράγοντες π.χ. χλωριούχος υδράργυρος, πικρικό οξύ.
Παράγοντες οι οποίοι επηρεάζουν τη μονιμοποίηση είναι:
- Η συγκέντρωση Η+ : Ικανοποιητική μονιμοποίηση pH: 6-8.
- Η θερμοκρασία (Θ): κατάλληλη είναι η θερμοκρασία δωματίου (αν οι ιστοί μονιμοποιούνται για παρατήρηση στο ηλεκτρονικό μικροσκόπιο η θερμοκρασία προσδιορίζεται μεταξύ 0-4o C).
- Η διεισδυτικότητα: Η διεισδυτικότητα των συνήθων μονιμοποιητικών είναι αργή ή περιορισμένη. Συνεπώς μεγάλα ιστοτεμάχια δεν μονιμοποιούνται επαρκώς ιδιαίτερα στο κέντρο της μάζας τους με επακόλουθο οι διαδικασίες της αυτόλυσης να συνεχίζονται.
- Η ωσμωτικότητα.
- Η συγκέντρωση-πυκνότητα του διαλύματος: Το συχνότερα χρησιμοποιούμενο μονιμοποιητικό υγρό, είναι το ουδέτερο διάλυμα φορμόλης σε πυκνότητα 10% (βλέπε: μονιμοποίηση “Ενέργειες στην κτηνιατρική πράξη”).
- Η χρονική διάρκεια μονιμοποίησης: Η διάρκεια μονιμοποίησης εξαρτάται από το μέγεθος των ιστοτεμαχίων, το είδος του ιστού και το είδος του μονιμοποιητικού. Συνήθως επαρκούν 24-48 ώρες. Προσοχή: η παρατεταμένη παραμονή του ιστού στη φορμόλη προκαλεί συρρίκνωσή του και καταστροφή ορισμένων αντιγόνων.
- Η σχέση όγκου διαλύματος υγρού / όγκο ιστού: Ο όγκος του μονιμοποιητικού υγρού πρέπει να είναι τουλάχιστον δεκαπλάσιος του όγκου του ιστοτεμαχίου.
> Ενέργειες στην κτηνιατρική πράξη
Μονιμοποίηση
1.Αν η λήψη βιοψιών γίνεται για ιστοπαθολογική εξέταση-διάγνωση ρουτίνας, ο ευκολότερος τρόπος μονιμοποίησης είναι η χρήση διαλύματος φορμόλης 10%. Δηλαδή, αραιώνουμε το εμπορικό σκεύασμα “φορμόλη” (formol ή formalin), με απεσταγμένο νερό σε αναλογία 1:10.
Διάλυμα φορμόλης 10%
Φορμόλη (37-40% Formaldehyde) 100 ml
Απεσταγμένο νερό (Distilled water) 900ml
Διευκρινίζεται ότι ο εμπορικός και χρησιμοποιούμενος όρος “φορμόλη”, αναφέρεται σε διάλυμα περίπου 37-40% αερίου φορμαλδεΰδης σε νερό με προσθετικό 10-15% μεθανόλη για πρόληψη πολυμερισμού.
Αν έχουμε την δυνατότητα επιλέγουμε να μονιμοποιήσουμε-συντηρήσουμε τον ιστό σε ουδέτερο (ρυθμιστικό) διάλυμα φορμόλης:
10% oυδέτερο ρυθμιστικό διάλυμα φορμόλης
(Neutral buffered formalin)
Φορμόλη (37-40% Formaldehyde) 100 ml
Απεσταγμένο νερό (Distilled water) 900ml
Μονοβασικό φωσφορικό νάτριο (Sodium dihydrogen phosphate Dihydrate, NaH2PO4.2H2O) 4 g
Διβασικό φωσφορικό νάτριο, άνυδρο (di-sodium hydrogen phosphate anhydrous, Na2HPO4) 6,5 g
2. Αν η λήψη βιοψιών γίνεται για ερευνητικούς σκοπούς είναι επιβεβλημένο η μονιμοποίηση ή η συντήρηση των δειγμάτων να γίνεται σε ουδέτερο (ρυθμιστικό) διάλυμα φορμόλης. Ιδιαίτερη προσοχή δίνεται ώστε να αποφευχθεί η παρατεταμένη διάρκεια μονιμοποίησης η οποία οδηγεί σε συρρίκνωση του ιστού αλλά και καταστροφή ορισμένων αντιγόνων.
3. Αν τα ιστολογικά δείγματα προορίζονται για εξέταση με ανοσοφθορισμό αλλά και σε περιπτώσεις που της ιστοπαθολογικής εξέτασης ενδέχεται να ακολουθήσει ανοσοϊστοχημική εξέταση (π.χ. σε λεμφώματα για Τ- , Β- λεμφοκύτταρα, ανίχνευση αντιγόνων ιών, δείκτες κακοήθειας κλπ.) θα πρέπει να γίνεται συνεννόηση με το ιστοπαθολογικό εργα- στήριο προορισμού των δειγμάτων για τον καθορισμό του τρόπου μονιμοποίησης που πρέπει να εφαρμοσθεί αφού ως γνωστό κάποια αντιγόνα καταστρέφονται σε διαλύματα φορμόλης, ενώ πολλά αντισώματα αντιδρούν μόνο σε τομές ψύξεως (cryosections). Στις περιπτώσεις αυτές πρέπει και πάλι να αποφεύγεται η παρατεταμένη διάρκεια μονιμοποίησης η οποία οδηγεί σε καταστροφή αντιγόνων.
4. Αν η ιστοπαθολογική εξέταση πρόκειται να γίνει σε τομές ψύξεως ο ιστός ψύχεται σε υγρό άζωτο. Τα ιστοτεμάχια τοποθετούνται σε αλουμινόχαρτο και εμβυθίζονται για ένα λεπτό στο υγρό άζωτο. Στη συνέχεια και μέχρι να αποσταλούν διατηρούνται σε βαθειά κατάψυξη (Θ: -60 έως -80 ⁰C).
5. Αν ο ιστός πρόκειται να εξεταστεί στο ηλεκτρονικό μικροσκόπιο επιλέγουμε να μονιμοποιήσουμε-συντηρήσουμε τον ιστό σε γλουταραλδεΰδη 4% ή παραφορμαλδεΰδη 10%. Τα παραπάνω διαλύματα διατηρούνται σε ψύξη (Θ: ~4⁰C).
6. Σε περιπτώσεις “επείγουσας βιοψίας” (διενέργεια της εξέτασης κατά τη διάρκεια του χειρουργείου) ο ιστός τεμαχίζεται σε λεπτά τεμάχια και μονιμοποιείται σε ειδικό αλκοολούχο διάλυμα π.χ. διάλυμα Clark’s ή μονιμοποιητικό Carnoy’s ή γίνεται μονιμοποίηση σε κατάψυξη ή σε φούρνο μικροκυμάτων.
Διάλυμα Clark (Clark’s solution)
Απόλυτη αλκοόλη (Absolute alcohol) 75 ml
Κρυσταλλικό οξικό οξύ (Glacial acetic acid ) 25 ml
Μονιμοποιητικό Carnoy (Carnoy’s fixative)
Απόλυτη αλκοόλη (Absolute alcohol) 60 ml
Χλωροφόρμιο (Chloroform) 30 ml
Κρυσταλλικό οξικό οξύ (Glacial acetic acid) 10 ml
> Επισημάνσεις όσο αφορά στη διαχείριση των μονιμοποιητικών υγρών και την επιλογή των δοχείων ιστών
- Η μονιμοποίηση θα πρέπει να γίνεται αμέσως μετά τη λήψη του ιστού ώστε να αποφευχθούν οι αυτολυτικές αλλοιώσεις. Στις περιπτώσεις που δεν είναι δυνατή η άμεση μονιμοποίηση των ιστολογικών δειγμάτων θα πρέπει να διατηρούνται σε περιβάλλον με υγρασία (τα τυλίγουμε σε γάζα εμποτισμένη σε φυσιολογικό ορό) και να τοποθετούνται το συντομότερο δυνατό στο μονιμοποιητικό υγρό.
- Για την μονιμοποίηση και μεταφορά των δειγ- μάτων να μην χρησιμοποιούνται περιέκτες με στενό στόμιο καθώς οι ιστοί με τη μονιμοποίηση γίνονται σκληροί και χάνουν την ελαστικό- τητά τους με αποτέλεσμα να είναι αδύνατη η εξαγωγή τους από τον περιέκτη.
- Αν στο διάλυμα φορμόλης διαπιστώσουμε την παρουσία λευκών κροκίδων αυτό σημαίνει ότι έχει μειωθεί η ισχύς του και είναι ακατάλληλο για χρήση.
- Οι χειρισμοί μας με τα μονιμοποιητικά υγρά (αλδεϋδες → φορμόλη) πρέπει να είναι προσεκτικοί λόγω της τοξικότητάς τους. Δεν πρέπει να έρχονται σε επαφή με το δέρμα ή τους βλεννογόνους μας ή να εισπνέονται. Σε περίπτωση ατυχήματος ξεπλένουμε με άφθονο νερό και σε πιο σοβαρές καταστάσεις επικοινωνούμε με το κέντρο δηλητηριάσεων.
> Διαχείριση ιστών, οργάνων ή ιστοτεμαχίων
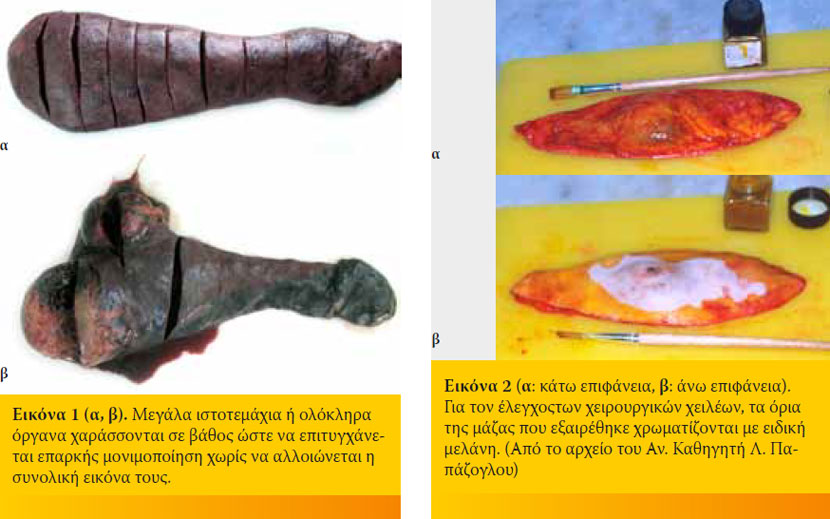
- Επειδή, όπως προαναφέρθηκε, η διεισδυτικότητα των μονιμοποιητικών υλικών είναι περιορισμένη, μεγάλα ιστοτεμάχια δεν μονιμοποιούνται επαρκώς ιδιαίτερα στο κέντρο τους, με επακόλουθο οι διαδικασίες αυτόλυσης να συνεχίζονται. Για αποτελεσματική μονιμοποίηση, τα ιστοτεμάχια πρέπει να έχουν πάχος μικρότερο από 1-2cm (ιδανικό πάχος μικρότερο του 0,5 cm). Καθώς, όμως, είναι σημαντικό ο παθολογοανατόμος να έχει τη συνολική εικόνα του ιστού που εξαιρέθηκε και να επιλέγει ο ίδιος τα ιστοτεμάχια που θα εξεταστούν, είναι προτιμότερο τα μεγάλα ιστοτεμάχια να χαράσσονται σε βάθος, ώστε να διευκολύνεται ο εμποτισμός τους, χωρίς όμως να διατέμνονται πλήρως (Εικόνα 1α, β). Αυτό είναι ιδιαίτερα σημαντικό στις περιπτώσεις των νεοπλασμάτων, όπου στις απαιτούμενες εξετάσεις είναι και ο έλεγχος των χειρουργικών χειλέων του ιστού που εξαιρέθηκε, ώστε να διερευνηθεί αν η εξαίρεση του ήταν επαρκής (ολική). Ιδανικά, στις περιπτώσεις που απαιτείται ο έλεγχος των χειρουργικών χειλέων, τα όρια της μάζας που εξαιρέθηκε θα πρέπει να χρωματίζονται με ειδική μελάνη (Εικόνα 2α, β). Έτσι, σε περίπτωση διατομής του ιστοτεμαχίου, είναι δυνατή η αναγνώριση των εξωτερικών ορίων του.
- Όταν το μέγεθος του ιστού που εξαιρέθηκε είναι εξαιρετικά μεγάλο ή πρόκειται για ολόκληρο όργανο (π.χ. σπλήνας, μαστός) ώστε να είναι αδύνατη η μεταφορά του χωρίς να τεμαχιστεί, είναι σημαντικό να αποστέλλεται στο ιστοπαθολογικό εργαστήριο φωτογραφία ή απλό σχηματογράφημα, στα οποία να επισημαίνονται το μέγεθος του ιστοτεμαχίου πριν τη διατομή του και το σημείο από όπου έχει ληφθεί το δείγμα που αποστέλλεται.
- Όταν το μέγεθος του ιστού που εξαιρέθηκε είναι εξαιρετικά μικρό (μυελός των οστών, διαδερμική βιοψία ήπατος, βιοψίες νεφρού, ενδοσκοπικές βιοψίες ρινικού ή γαστρικού βλεννογόνου, κλπ.) συστήνεται τα ιστοτεμάχια να τοποθετούνται στο μονιμοποιητικό υγρό τυλιγμένα σε διηθητικό χαρτί ή σε ειδικές για το σκοπό αυτό κασετίνες (Εικόνα 3α, β, γ, δ).

- Αν τα ιστοτεμάχια που αφαιρέθηκαν καλύπτονται από μεγάλη ποσότητα αίματος συστήνεται να ξεπλένονται με φυσιολογικό ορό πριν τοποθετηθούν στο μονιμοποιητικό υγρό καθώς η παρουσία του αίματος καθυστερεί τη διαδικασία της μονιμοποίησης. Εναλλακτικά συστήνεται η απόρριψη της φορμόλης μετά από 24 ώρες και η τοποθέτηση νέας.
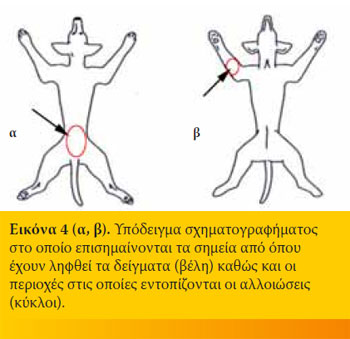
- Ειδικά για τις βιοψίες δέρματος, είναι σημαντικό να αποστέλλεται στο ιστοπαθολογικό εργαστήριο ένα απλό σχηματογράφημα στο οποίο να επισημαίνονται τα σημεία από όπου έχουν ληφθεί τα δείγματα καθώς και οι περιοχές στις οποίες εντοπίζονται οι αλλοιώσεις (Εικόνα 4α,β).
> Ειδικές περιπτώσεις ιστών
Οστά
Η μονιμοποίηση των οστών γίνεται σε διάλυμα φορμόλης, όπως και για τους υπόλοιπους ιστούς. Η διαδικασία αφαλάτωσης επακολουθεί της μονιμοποίησης και γίνεται στο ιστοπαθολογικό εργαστήριο 2 περίπου ημέρες μετά την μονιμοποίηση σε φορμόλη.
Σε περιπτώσεις ακρωτηριασμού που ζητείται η ιστοπαθολογική εξέταση του οστού, αφαιρούνται το δέρμα και τα μαλακά μόρια που το περιβάλλουν και επιλέγεται το ιστοτεμάχιο του οστού που επιθυμούμε να εξεταστεί. Αν αυτό δεν είναι δυνατό να γίνει άμεσα στο χειρουργείο, διατηρούμε το ακρωτηριασμένο άκρο σε ψύξη (4 ⁰C) μέχρι να πραγματοποιηθεί η αφαίρεση των γύρω ιστών.
Μήτρα
Στις περιπτώσεις ωοθυκυστερεκτομής στις οποίες αποστέλλεται για παθολογοανατομική εξέταση ολόκληρη η μήτρα, διατέμνουμε τα δύο κέρατα μόνο στην πλάγια επιφάνειά τους, ώστε να παραμένουν ενωμένα στο σώμα της, και στη συνέχεια, εάν πρόκειται για μήτρα μεγαλόσωμου ζώου, χαράσσουμε εγκάρσια τα κέρατα ανά 1-1,5 cm.
Έντερο
 Τα προς εξέταση ιστοτεμάχια του εντέρου μπορεί να είναι τεμάχια που ελήφθησαν ενδοσκοπικά ή να αποτελούν τμήματα του εντέρου που προήλθαν από εντεροτομή ή εντερεκτομή. Οι βιοψίες του εντέρου που ελήφθησαν ενδοσκοπικά, οι οποίες είναι συνήθως μεγέθους κεφαλής καρφίτσας, πρέπει να τοποθετούνται μεταξύ φύλλων διηθητικού χαρτιού ή σε ειδικές κασετίνες και ευθύς αμέσως στο μονιμοποιητικό υγρό. Όσο αφορά σε τμήματα του εντέρου που έχουν ληφθεί μετά από εντερεκτομή, δύο τρόποι προτείνονται για τη διαχείρισή τους: 1) Στο τμήμα του εντέρου που έχει αποκοπεί απομακρύνουμε το περιεχόμενο διοχετεύοντας προσεκτικά φυσιολογικό ορό με μια σύριγγα χωρίς βελόνα. Στη συνέχεια γεμίζουμε το έντερο με φορμόλη και το τοποθετούμε σε δοχείο φορμόλης. Με αυτόν τον τρόπο αποφεύγεται η σύμπτωση των τοιχωμάτων του και η καταστροφή των λαχνών. Μετά τη μονιμοποίηση γίνονται
Τα προς εξέταση ιστοτεμάχια του εντέρου μπορεί να είναι τεμάχια που ελήφθησαν ενδοσκοπικά ή να αποτελούν τμήματα του εντέρου που προήλθαν από εντεροτομή ή εντερεκτομή. Οι βιοψίες του εντέρου που ελήφθησαν ενδοσκοπικά, οι οποίες είναι συνήθως μεγέθους κεφαλής καρφίτσας, πρέπει να τοποθετούνται μεταξύ φύλλων διηθητικού χαρτιού ή σε ειδικές κασετίνες και ευθύς αμέσως στο μονιμοποιητικό υγρό. Όσο αφορά σε τμήματα του εντέρου που έχουν ληφθεί μετά από εντερεκτομή, δύο τρόποι προτείνονται για τη διαχείρισή τους: 1) Στο τμήμα του εντέρου που έχει αποκοπεί απομακρύνουμε το περιεχόμενο διοχετεύοντας προσεκτικά φυσιολογικό ορό με μια σύριγγα χωρίς βελόνα. Στη συνέχεια γεμίζουμε το έντερο με φορμόλη και το τοποθετούμε σε δοχείο φορμόλης. Με αυτόν τον τρόπο αποφεύγεται η σύμπτωση των τοιχωμάτων του και η καταστροφή των λαχνών. Μετά τη μονιμοποίηση γίνονται
τομές του εντέρου είτε επιμήκεις είτε εγκάρσιες. 2) Το τμήμα του εντέρου που έχει αποκοπεί διανοίγεται με ψαλίδι κατά μήκος της πρόσφυσης του μεσεντερίου. Το ανοικτό πλέον τμήμα του εντέρου ξεπλένεται προσεκτικά ώστε να απομακρυνθεί το περιεχόμενό του και καθηλώνεται σε τεμάχιο φελλού με το βλεννογόνο προς τα επάνω (Εικόνα 5) και στη συνέχεια τοποθετείται στο μονιμοποιητικό υγρό. Με αυτόν τον τρόπο το τμήμα του εντέρου παραμένει επίπεδο. Σε αντίθετη περίπτωση συσπάται ο μυϊκός χιτώνας και το έντερο αναδιπλώνεται.
Μύες
 Η καθήλωση ιστού σε τεμάχιο φελλού ή σε γλωσσοπίεστρο είναι επιβεβλημένη και στην περίπτωση βιοψίας μυός, διότι η σύσπασή του επικαλύπτει τυχόν υπάρχουσες αλλοιώσεις. Η καθήλωση πρέπει να γίνεται κατά την κατεύθυνση των μυϊκών ινών (Εικόνα 6). Εναλλακτικά, εμβαπτίζεται το ιστοτεμάχιο σε φυσιολογικό ορό για 15-30 λεπτά, ώστε να μειωθούν τα αποθέματα γλυκογόνου και μετά τοποθετείται στη φορμόλη.
Η καθήλωση ιστού σε τεμάχιο φελλού ή σε γλωσσοπίεστρο είναι επιβεβλημένη και στην περίπτωση βιοψίας μυός, διότι η σύσπασή του επικαλύπτει τυχόν υπάρχουσες αλλοιώσεις. Η καθήλωση πρέπει να γίνεται κατά την κατεύθυνση των μυϊκών ινών (Εικόνα 6). Εναλλακτικά, εμβαπτίζεται το ιστοτεμάχιο σε φυσιολογικό ορό για 15-30 λεπτά, ώστε να μειωθούν τα αποθέματα γλυκογόνου και μετά τοποθετείται στη φορμόλη.
Όρχεις
Όταν η ιστοπαθολογική εξέταση των όρχεων γίνεται για ερευνητικούς σκοπούς ή και σε περιπτώσεις που επιδιώκεται η εκτίμηση των χαρακτηριστικών των σπερματικών κυττάρων (π.χ. αζωοσπερμία/ολιγοσπερμία) επιλέγουμε να μονιμοποιήσουμε τον ιστό σε διάλυμα Bouin (Bouin’s solution).
Διάλυμα Bouin (Bouin’s solution)
Κορεσμένο υδατικό διάλυμα πικρικού οξέως (Saturated aqueous picric acid solution) 75ml
Φορμόλη (37-40% Φορμαλδεϋδη) 25ml
Κρυσταλλικό οξικό οξύ (Glacial acetic acid) 5ml
Το διάλυμα Bouin έχει μεγάλη διεισδυτικότητα και αφήνει τον ιστό μαλακό.
> Διαχείριση ιστών και οργάνων νεκρού ζώου
Σε περιπτώσεις όπου η λήψη οργάνων και ιστών, προκειμένου να πραγματοποιηθεί ιστοπαθολογική εξέταση, γίνεται από νεκρό ζώο ο τρόπος διαχείρισής τους είναι ο ίδιος όπως περιγράφηκε μέχρι τώρα. Παρακάτω περιγράφεται ο τρόπος διαχείρισης του εγκεφάλου.
Εγκέφαλος
Ο νευρικός ιστός εμφανίζει πολύ σύντομα μεταθανάτιες αυτολυτικές μεταβολές, οι οποίες είναι δύσκολο να διακριθούν από πρόσφατες αλλοιώσεις εκφύλισης. Έτσι για καλύτερα αποτελέσματα θα πρέπει ο εγκέφαλος να τοποθετείται σε μονιμοποιητικό υγρό ευθύς αμέσως μετά την εξαίρεσή του από το κρανίο. Η τελευταία μάλιστα ενέργεια πρέπει να προηγείται οποιασδήποτε άλλης εξέτασης οργάνων σε περιπτώσεις που υπάρχει ιστορικό αλλοιώσεων του εγκεφάλου. Η αλατούχος φορμόλη είναι το μονιμοποιητικό επιλογής στην προκειμένη περίπτωση επειδή ο ιστός παραμένει μαλακός εξωτερικά και έτσι αυξάνεται η διεισδυτικότητα της φορμόλης. Μετά από 24 ώρες απορρίπτεται η φορμόλη, ο εγκέφαλος τεμαχίζεται εγκαρσίως σε τμήματα πάχους 1 cm περίπου και τοποθετείται σε νέα φορμόλη για τελική μονιμοποίηση.
10% διάλυμα αλατούχου φορμόλης
Φορμόλη (37-40% Formaldehyde) 100 ml
Χλωριούχο νάτριο (Sodium chloride, NaCl) 90 gr
Νερό βρύσης ( Tap water) 900ml
> Παραπεμπτικό για ιστοπαθολογική εξέταση
Στο παραπεμπτικό πρέπει να αναφέρονται:
- Τα στοιχεία του ζώου (ηλικία, φύλο, φυλή).
- Το ιστορικό (εκτός από τη συμπτωματολογία να αναφέρεται και αν έχει γίνει θεραπεία και τι είδους καθώς αυτή ενδέχεται να επηρεάζει την ιστοποθολογική εικόνα).
- Η κλινική διάγνωση ή διαφορική διάγνωση.
- Αποτελέσματα άλλων εξετάσεων (π.χ. ακτινολογικός, υπερηχοτομογραφικός έλεγχος και ιδιαίτερα αποτελέσματα κυτταρολογικών εξετάσεων ή προηγούμενων ιστοπαθολογικών εξετάσεων). Η παροχή αυτών των πληροφοριών, συμβάλει στη σωστή διάγνωση και επομένως στην καλύτερη προστασία της υγείας του
ζώου. - Ο τρόπος λήψης του δείγματος (ολική εκτομή, μερική εκτομή, λήψη βιοψίας, αναρρόφηση κτλ.) και εάν αποστέλλεται ολόκληρο το ιστοτεμάχιο που αφαιρέθηκε ή μόνο τμήμα αυτού. Αν η λήψη των βιοψιών έχει γίνει ενδοσκοπικά ή σε περιπτώσεις που έχει χρησιμοποιηθεί διαθερμία, αυτό πρέπει να επισημαίνεται ώστε να μην παρερμηνευτούν τυχόν βλάβες του ιστού που προκλήθηκαν από τους χειρισμούς.
- Η ημερομηνία λήψης-μονιμοποίησης των ιστολογικών δειγμάτων.
 > Αποστολή
> Αποστολή
- Τα δοχεία με τους ιστούς σε διαλύματα φορμόλης πρέπει να τοποθετούνται σε κιβώτιο με επαρκή ποσότητα απορροφητικού υλικού (π.χ. χαρτί) ώστε να αντιμετωπιστούν τυχόν διαρροές. Το ίδιο ισχύει και για τα διαλύματα γλουταραλδεΰδης και παραφορμαλδεΰδης. Στην περίπτωση που, της αποστολής των
δειγμάτων έχει προηγηθεί παραμονή τους για τουλάχιστον 24-48 h σε μονιμοποιητικό υγρό δεκαπλάσιου όγκου, είναι δυνατό τα δείγματα να τοποθετηθούν σε περιέκτη και με μικρότερη ποσότητα μονιμοποιητικού υγρού ώστε να διευκολυνθεί η μεταφορά και να αποφευχθούν διαρροές του υγρού. Η αποστολή του υλικού γίνεται σε θερμοκρασία περιβάλλοντος. - Οι ιστοί που έχουν καταψυχθεί τοποθετούνται σε πλαστικό περιέκτη που έχει προψυχθεί και στη συνέχεια σε κιβώτιο από φελιζόλ που περιέχει επαρκή ποσότητα ξηρού πάγου. Επισημαίνεται ότι μεταφέρεται υλικό σε ξηρό πάγο.
- Οι περισσότερες εταιρείες μεταφοράς αναλαμβάνουν την αποστολή των δειγμάτων. Σε ορισμένες περιπτώσεις απαιτείται η σύνταξη βεβαίωσης ότι το βιολογικό υλικό που μεταφέρεται δεν είναι μολυσματικό και επικίνδυνο για τη δημόσια υγεία, κάτι που όντως ισχύει για ιστούς σε διαλύματα φορμόλης.
> Προτεινόμενη βιβλιογραφία
1. Kamstock DA, Ehrhart EJ, Getzy DM, Bacon NJ, Rassnick KM, Moroff SD, Liu SM, Straw RC, McKnight CA, Amorim RL, Bienzle D, Cassali GD, Cullen JM, Dennis MM, Esplin DG, Foster RA, Goldschmidt MH, Gruber AD, Hellmén E, Howerth EW, Labelle P, Lenz SD, Lipscomb TP, Locke E, McGill LD, Miller MA, Mouser PJ, O’Toole D, Pool RR, Powers BE, Ramos-Vara JA, Roccabianca P, Ross AD, Sailasuta A, Sarli G, Scase TJ, Schulman FY, Shoieb AM, Singh K, Sledge D, Smedley RC, Smith KC, Spangler WL, Steficek B, Stromberg PC, Valli VE, Yager J, Kiupel M; American College of Veterinary Pathologists’ Oncology Committee. Recommended guidelines for submission, trimming, margin evaluation, and reporting of tumor biopsy specimens in veterinary surgical pathology. Vet Pathol 2011, 48: 19-31.
2. Bancroft J, Gamble M. Theory and Practice of Histological Techniques. 5th edn. Churchill Livingstone.




